
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)==C(金刚石)△H=+1.90 kJ·mol-1可知,金刚石比石墨稳定
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1-丁醇,查阅资料得知下列合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO ![]() CH3CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2OH;CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置如图所示。
CO↑+H2O,并设计出原料气的制备装置如图所示。
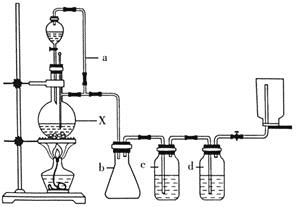
请填写下列空白:
(1)若用以上装置制备干燥纯净的CO,仪器X的名称是________;装置中b的作用是________;c和d中盛装的试剂分别是________,________。
(2)实验室现有浓硫酸、2-丙醇,请写出制备丙烯的化学方程式:________________________。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁、戊五种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与 |
丁 | ①相对分子质量比丙少;②能由丙氧化而成 |
戊 | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应所得产物的名称是___________________。
(2)甲与氢气发生加成反应后生成物质己,在己在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式![]() 。当n=___________________时,这类有机物开始出现同分异构体。
。当n=___________________时,这类有机物开始出现同分异构体。
(3)乙具有的性质是___________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性![]() 溶液和溴水反应而使其褪色
溶液和溴水反应而使其褪色
(4)丙与戊反应能生成相对分子质量为100的酯,所发生反应的反应类型为_____________________,对应的化学方程式为_______________________。
(5)写出丙氧化生成丁的化学反应方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水检验淀粉是否完全水解
D. 可采取蒸馏的方法初步分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3。
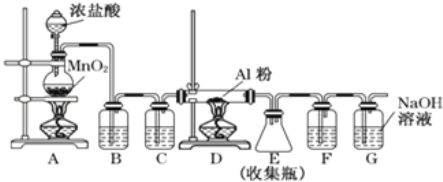
(1)装置A中发生反应的离子方程式为________________________________________
(2)装置B盛放的试剂是______,其作用是_______________________________;装置C盛放的试剂是__________,其作用是__________________________________
(3)装置G的作用是________________,G中发生反应的化学方程式是________________________________________
(4)F中盛放的试剂是______,其作用是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-20,下列说法正确的是
A.该溶液的pH一定是10B.该溶液不可能pH=4
C.该溶液的pH不可能是7D.不会有这样的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列问题。
(1)将等质量的锌粉分别投入10 mL 0.1 mol·L-1盐酸和10 mL 0.1 mol·L-1 CH3COOH溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(2)将等量的锌粉分别投入c(H+)均为1 mol·L-1、体积均为10 mL的盐酸和醋酸溶液中。若锌不足量,反应快的是________(填写盐酸溶液、醋酸溶液)。
(3)设水的电离平衡线如图所示。
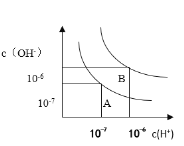
a.若以A点表示25°时水在电离平衡时的粒子浓度,当温度升高到100°时,水的电离平衡状态到B点,则此时水的离子积增加到____________;
b.将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100°的恒温,欲使混合溶液的pH=7,则Ba(OH) 2溶液和盐酸的体积比为___________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol/L (填准确数值)。
(5)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述正确的是________________。
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 mol·L-1
C.取该溶液加水稀释100倍,溶液中的水电离出的c(H+)减小
D.加入NaHSO4晶体抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式的为( )
A.向FeI2溶液中通入少量的氯气:Cl2+2Fe2+=2Fe3++2Cl-
B.光导纤维遇碱性土壤“短路”:SiO2+2OH-=SiO32-+H2O
C.电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.向明矾溶液中加入Ba(OH)2使Al3+刚好沉淀完全:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:4NO2(g)+O2(g)![]() 2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
2N2O5(g) ΔH<0,T1时,向体积为2L的恒容密闭容器中通入NO2和O2,部分实验数据如表所示。
时间/s | 0 | 5 | 10 | 15 |
c(NO2)/(mol·L-1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(mol·L-1) | 1.00 | c1 | c2 | 0.50 |
(1)0~10s内N2O5的平均反应速率为__ ,此温度下的平衡常数为___。
(2)其他条件不变,将容器体积压缩一半,则重新达到平衡时c(N2O5)___2.00mol·L-1(填“>、<或=”,下同)
(3)假设温度T1时平衡常数为K1,温度T2时平衡常数为K2,若K1<K2,则T1____T2。
(4)下列可以作为平衡的依据的是___
A.容器内混合气体的颜色不再改变
B.生成1molO2的同时消耗2molN2O5
C.混合气体的平均摩尔质量不再变化
D.混合气体的密度不再变化
(5)改变哪些措施可以增加NO2的平衡转化率___(答出任意两条及以上)
(6)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=﹣393.5 kJ·mol1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=___ kJ·mol1,利于该反应自发进行的条件是___(选填“高温”或“低温”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com