
(16分)白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:

(完全沉淀离子的pH值:SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是____________。CaWO4与纯碱发生的化学反应方程式是_______________________________。
(2)滤渣A的主要成分是(写化学式)_____________,滤渣B的化学式是__________。
(3)调节pH可选用的试剂是:__________。
A.氨水 B.氢氧化钠溶液 C.盐酸
(4)母液中加入盐酸的离子方程式为________________________________________。
(5)白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨_____kg。(已知钨酸钙的相对分子质量为288)
(1)增大接触面积,加快反应速率。(2分,每点1分)
CaWO4+Na2CO3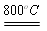 Na2WO4+CaO+CO2↑(3分,无↑不扣分,不写条件扣1分,分步写也可得分)
Na2WO4+CaO+CO2↑(3分,无↑不扣分,不写条件扣1分,分步写也可得分)
(2)Fe2O3 (多写Ca(OH)2不扣分) (2分) H2SiO3(2分)
(3)C (2分)
(4)WO42-+2H+=H2WO4↓(2分)
(5)110.4(3分,误差不大也可酌情给分)
【解析】
试题分析:第一步是白钨矿和纯碱在800oC条件下发生复分解反应生成Na2WO4和CaCO3,CaCO3分解生成CaO和CO2,另外白钨矿中还含有杂质二氧化硅、氧化铁等,二氧化硅与纯碱反应生成硅酸钠与二氧化碳,氧化铁不反应,故混合物的含有CaO、Na2WO4、Na2SiO3、Fe2O3;第二步水洗过滤后滤渣A为Fe2O3和少量的Ca(OH)2;第三步滤液呈碱性,为了除去Na2SiO3,用酸调节PH使Na2SiO3转化为滤渣B(H2SiO3)而除去;第四步母液继续用酸将Na2WO4转化为H2WO4;第五步,将H2WO4煅烧生成WO3,第六步WO3在高温条件下与H2反应制得纯W。
(1)白钨矿反应前进行粉碎,能增大反应物的接触面积,加快反应速率;白钨矿和纯碱在800oC条件下发生复分解反应生成Na2WO4和CaCO3,CaCO3分解生成CaO和CO2,故反应方程式为:CaWO4+Na2CO3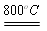 Na2WO4+CaO+CO2↑;(2)混合物通过水洗、过滤后杂质中氧化铁留在滤渣A中;用酸调节滤液的PH使Na2SiO3转化为H2SiO3留在滤渣B中;
Na2WO4+CaO+CO2↑;(2)混合物通过水洗、过滤后杂质中氧化铁留在滤渣A中;用酸调节滤液的PH使Na2SiO3转化为H2SiO3留在滤渣B中;
(3)滤液呈碱性,为了除去Na2SiO3,只能用酸调节PH使Na2SiO3转化为滤渣H2SiO3而将其除去,故选C(盐酸);(4)母液中加入盐酸,与Na2WO4反应,故离子方程式为:WO42-+2H+=H2WO4↓;(5)CaWO4中W的质量分数为:W%=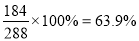 ,白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨576 kg×63.9%×30%=110.4kg。
,白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨576 kg×63.9%×30%=110.4kg。
考点:考查金属资源的回收利用。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 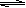 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
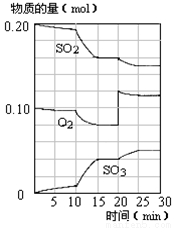
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列离子方程式中,不正确的是
A.向FeCl2溶液中通入 Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Clˉ
B.FeCl3溶液跟过量氨水 Fe3+ + 3NH3?H2O = Fe(OH)3↓ + 3NH4+
C.碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2 + 2H+ = Ca2+ + 2H2O + 2CO2↑
D.钠与水的反应 2Na + 2H2O = 2Na+ + 2OH- + H2↑
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:实验题
(16分)Ⅰ、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
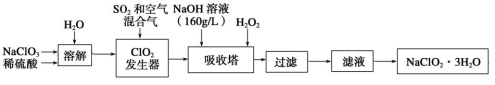
已知:
① NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
② 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③ 160 g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1 L。
(1)160 g/L NaOH溶液的物质的量浓度为: (结果保留三位有效数字)
(2)发生器中鼓入空气的作用是: 。
(3)写出吸收装置内发生反应的化学方程式,并标出电子转移方向和数目: ;吸收装置中的温度不能过高,其原因是: 。
(4)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是_____(选填序号)
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
Ⅱ、在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 KOCN + 2KCl + H2O
KOCN + 2KCl + H2O
再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:
____ KOCN + ____ KOH + ____Cl2 ____ CO2 + ____ N2 + ____ KCl + ____H2O
____ CO2 + ____ N2 + ____ KCl + ____H2O
(2)实验室用MnO2与浓HCl制取Cl2, 在答卷上画出虚线框内制取Cl2的装置图,并标出实验药品。
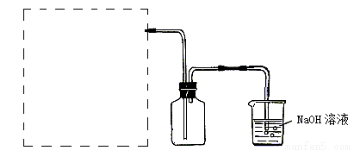
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是
A.单质的还原性:Y>Z
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X<W
D.Y和Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
常温下,0.1 mol·L-1CH3COONa溶液pH=11,下列表述正确的是
A.c(Na+) = c(CH3COO—)
B.c(CH3COO—) + c(CH3COOH)=0.1 mol·L-1
C.由水电离出来的c(OH—)= 1.0×10-11 mol·L-1
D.往该溶液中加入0.05 mol·L-1的CH3COONa,pH值变大
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:实验题
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
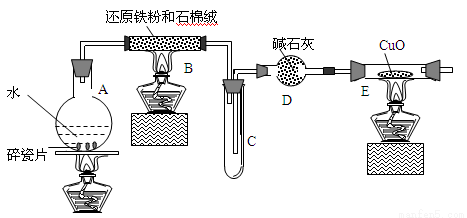
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:滤液(步骤I)→FeCl3溶液(步骤II)→FeCl3·6H2O晶体
①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括: 。③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
对于常温下pH=3的乙酸溶液,下列说法正确的是
A.与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH升高
D.溶液中粒子浓度大小关系为: c(H+)>c(CH3COOH) > c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
材料与化学密切相关,表中对应关系错误的是( )
选项 | 材料 | 主要化学成分 |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com