
 钠型离子交换剂磺化煤(NaR)可使硬水的Ca2+、Mg2+通过离子交换而软化.现代海水的淡化方法是使海水(含Na+、Mg2+、Ca2+、Cl-等)依次通过两种离子交换树脂A、B(如图所示),下列说法不正确的是( )
钠型离子交换剂磺化煤(NaR)可使硬水的Ca2+、Mg2+通过离子交换而软化.现代海水的淡化方法是使海水(含Na+、Mg2+、Ca2+、Cl-等)依次通过两种离子交换树脂A、B(如图所示),下列说法不正确的是( )| A、A为氢型阳离子交换树脂(HR),B为羟型阴离子换树脂(ROH) |
| B、A为羟型阳离子交换树脂(ROH),B为氢型阳离子交换树脂(HR) |
| C、HR与Na+的反应可表示为HR+Na+═NaR+H+ |
| D、由中性海水用此方法得到的淡水pH不变 |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
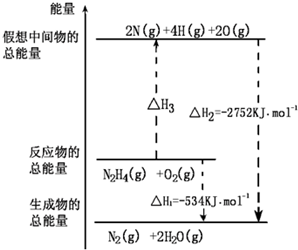 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )| A、1327 | B、391 |
| C、516 | D、154 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |
| C、加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
| D、高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B、在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| C、在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加少量NaOH固体平衡向正反应方向移动 |
| B、温度升高,平衡向逆反应方向移动 |
| C、加入少量0.1mol/LHCl溶液C(H+)减小 |
| D、加入少量NaF固体HF的电离程度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com