
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)分析 (1)运用盖斯定律,利用反应ⅰ的逆反应且系数乘3再加上反应ⅱ的正反应且系数要乘以4,即可计算出反应的热效应为-117kJ•mol-1;
(2)根据Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)计算出c(Ag+),再根据Ksp(AgCl)=c(Ag+)•c(Cl-)计算出c(Cl-);
(3)①据四氯化硅的转化率来分析;
②升高温度,反应速率加快来分析;
(4)(i)根据v=$\frac{△c}{△t}$计算v(SiHCl3),再利用速率之比等于其化学计量数之比计算v(SiCl4);
(ii)w=$\frac{n变}{n总}×100%$进行计算;温度升高平衡逆向移动故K值减小;
(iii)若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动;
(iv)平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度.
解答 解:(1):①Si(s)+4HCl(g)?SiCl4(g)+2H2(g)△H1=-241kJ•mol-1
②Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H2=-210kJ•mol-1,②×4-①×3得:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g),故△H=4×(-210kJ•mol-1)-3×(-241kJ•mol-1)=-117kJ•mol-1,
故答案为:-117KJ•mol-1;
(2)Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-),则c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{l.0×1{0}^{-12}}{(0.01)}}$=l.0×10-5,Ksp(AgCl)=c(Ag+)•c(Cl-),故c(Cl-)=$\frac{Ksp(AgCl)}{c((A{g}^{+})}$=$\frac{1.8×1{0}^{-10}}{1.0×1{0}^{-5}}$=1.8×10-5,
故答案为:1.8×10-5;
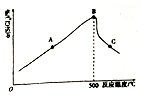
(3)①四氯化硅的转化率最小时,则能说明SiHCl3(g)的正反应速率小于SiHCl3(g)的逆反应速率,故为点C,
故答案为:C;
②温度低于500℃时,随着温度升高,四氯化硅的转化率增大,其原因是500℃之前反应未达到平衡,升高温度,反应速率加快,
故答案为:500℃之前反应未达到平衡,升高温度,反应速率加快;
(4)(i)tmin后达到平衡,SiHCl3的物质量浓度为0.2mol.L-1,则v(SiHCl3)=$\frac{1mol/L}{tmin}$=$\frac{1}{t}$mol/(L.min),速率之比等于其化学计量数之比,则v(SiCl4)=$\frac{3}{4}$v(SiHCl3)=$\frac{3}{4t}$mol/(L.min),
故答案为:$\frac{3}{4t}$mol/(L.min);
(ii) 3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
开始(c) 0
变化 0.75 0.5 1
tmin 2 1
w(H2)=$\frac{0.5}{2+0.5}$×100%=20%;该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,
故答案为:20%;减小;
(iii)若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动,有方程式可知1mol氢气反应时,混合气体总物质的量减小1mol,故到达新平衡时氢气的体积分数减小,
故答案为:减小;
(iv)平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值为2×2mol•L-1=4mol•L-1,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度2mol•L-1,故再次达到平衡时,H2的物质的量浓度范围为:2mol•L-1<c(H2)<4mol•L-1,
故答案为:2mol•L-1<c(H2)<4mol•L-1.
点评 本题考查方程式书写、反应热计算、化学反应速率计算、平衡常数及影响因素、化学平衡计算及移动等,(4)中(iv)注意利用极限法与平衡移动原理方向解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
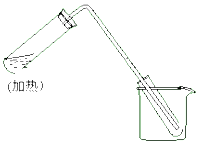 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +nCH3OH$→_{△}^{浓H_{2}SO_{4}}$
+nCH3OH$→_{△}^{浓H_{2}SO_{4}}$ +2nH2O.
+2nH2O. $?_{△}^{催化剂}$
$?_{△}^{催化剂}$ +2nCH3OH.
+2nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 | B. | NaAl(OH)2CO3 | C. | Mg(OH)2 | D. | BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
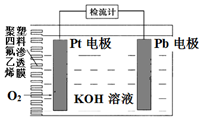 电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )
电池式氧传感器原理构造如图,可测定O2的含量.工作时铅极表面会逐渐附着Pb(OH)2.下列说法不正确的是( )| A. | Pt电极上发生还原反应 | |
| B. | 随着使用,电解液的pH逐渐减小 | |
| C. | a mmolO2反应,理论上可使Pb电极增重68a mg | |
| D. | Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com