
【题目】四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是

A. 在a、b、c、d、e中,水电离程度最大的点是d
B. c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C. 曲线I中c与e之间某点溶液呈中性
D. a点溶液pH=12
【答案】B
【解析】
A.由图像知,曲线1导电性较弱,说明曲线I对应的溶液为弱电解质溶液,即曲线I代表氨水,曲线2代表四甲基氢氧化铵,c点表示氨水与盐酸恰好完全反应生成氯化铵,水解程度最大,故此点对应的溶液中水的电离程度最大,故A错误;
B.c点表示溶质是氯化铵,质子守恒式为c(H+)=c(OH-)+c(NH3H2O),故B正确;
C.在氨水中滴加盐酸,溶液由碱性变中性,再变成酸性,滴定前氨水呈碱性,而c点对应的溶液呈酸性,说明中性点在c点向b点间的某点,c点到e点溶液的酸性越来越强,故C错误;
D.依题意,四甲基强氧化铵是一元强碱,c (OH-)=0.1molL-1,c(H+)=1×10-13 molL-1,pH=-lg c(H+)=13,故D错误。
故选B。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为___________。
(2)已知基态锌、铜的电离能如表所示:

由表格数据知,I2(Cu)>I2(Zn)的原因是__________。
(3)H2O分子中的键长比H2S中的键长______(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是_______。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为_________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______。
),则噻吩分子中的大π键应表示为______。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是___。1 mol吡咯含____mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是___。1 mol吡咯含____mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。

已知:硫化锌晶体密度为d g·cm3,NA代表阿伏加德罗常数的值,则Zn2和S2之间的最短核间距(x)为_________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
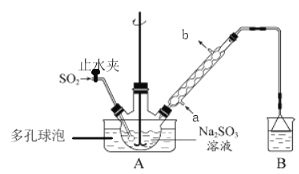
已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解。
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,将装置A中导气管换成橡皮塞,在80~90℃下,反应约3h,冷却至室温,抽滤将剩余锌粉与难溶性产物除去。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___________(填字母代号);
A.NaOH溶液 B.NaHSO3溶液 C.饱和NaCl溶液
冷凝管中冷却水从___________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_______________________________________________________。
(3)冷凝管中回流的主要物质除H2O外还有___________(填化学式)。
(4)写出步骤2中发生反应的化学方程式___________________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止_________。
(6)为了测定产品的纯度,准确称取2.0 g样品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.233 g,则所制得的产品的纯度为_____(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代在冶炼金属方面成就显著,请回答:
(1)商代司母戊鼎属于_____(选填“青铜”、“铁合金”或“铝合金”)制品。
(2)下图为铜及其化合物之间的转化关系(反应条件略去):

①上述转化常伴随颜色的变化,紫红色的铜与氧气反应生成______色的氧化铜;
②“曾青得铁则化为铜”体现了我国古代湿法炼铜的原理,其中的反应有:Fe + CuSO4 = FeSO4 + Cu,由此可知铁比铜的金属活动性________(选填写“强”或“弱”);
③为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是_______;
④由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径________(选填“甲”或“乙”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:

回答下列问题:
(1)丙二酸的结构简式为___________;E中含氧官能团的名称是___________。
(2)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成l mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为_______________________________________________________。
(3)D生成E的反应类型为_____________。
(4)已知碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出F中的手性碳:_______________。
(5)X是B的同分异构体,X同时满足下列条件的结构共有___________种(不考虑空间异构),其中核磁共振氢谱有五组峰的结构简式为______________。
①可与碳酸氢钠溶液反应生成二氧化碳;②遇FeCl3溶液发生显色反应;③除苯环外不含其他环。
(6)写出以苯甲醇和丙二酸为原料制备 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 人造纤维和化学纤维都是通过聚合反应生成的
B. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
C. 在用油脂制肥皂实验中,加入乙醇是为了增大油脂和NaOH溶液的接触面积,从而加快化学反应速率
D. 用牛油制肥皂,当在反应液中加入热的饱和食盐水并搅拌后,会发现烧杯底部有固体物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com