
【题目】下列反应的离于方程式书写正确的是
A. 向沸水中滴入FeCl3饱和溶液:Fe3+ +3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入过量二氧化硫:OH-+SO2=HSO3-
C. 将一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能够增大上述合成甲醇反应的反应速率的是(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2 , 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示. 
①p1p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2号 CH3OH各0.5amol,则平衡(填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”).
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示.在T1﹣T2及T4﹣T5两个温度区间,容器内甲醇的体积分数的变化趋势如图2所示,其原因是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
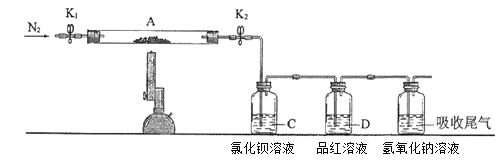
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是
选项 | ①中试剂 | ①中现象 | 解释 |
|
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 | |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 | |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 | |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有强还原性,工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等物质。
(1)下列物质的摩尔质量与肼的摩尔质量相同的是______(填字母)。
A.氧气 B.硫化氢 C.硅化氢 D.氟气
(2)上述生成水合肼的反应中尿素作_____(填“氧化剂”或“还原剂”),上述反应的化学方程式为_________________。
(3)发射“神舟飞船的长征火箭用肼作燃料,以二氧化氮作氧化剂,两者反应会生成氮气和水。该反应中每生成6.72L(标准状况)N2,转移电子的物质的量为________。
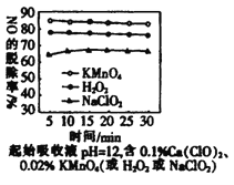
(4)肼燃烧易产生NO,可用漂白粉溶液脱除NO。为提高NO的脱除率,在其他条件相同时,向漂白粉溶液中分别加入三种不同添加剂,测得其对NO脱除率的影响如图所示。由图可知,KMnO4、H2O2、NaClO2的氧化性由弱到强的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点为-105℃,沸点为79℃,140℃以上时易分解。
(1)写出SOCl2吸收水蒸气的化学方程式:_________________
(2)甲同学设计如图所示装置,用ZnCl2·xH2O晶体制取无水ZnCl2、回收SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
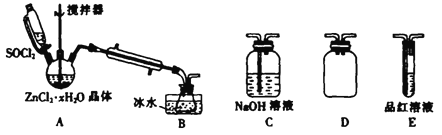
①装置的连接顺序为A→B→______→_____→_____。(填字母)
②冷凝管的作用是____________。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤、冼绦、干燥,称得固体为bg。若![]() =___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
=___ (精确至0.1),即可证明ZnCl2·xH2O晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验中会发生氧化还原反应。请你设计并简述实验方案判断丙同学的观点:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:
(1)单质铁属于晶体.黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
(2)铝的价电子排布式为 , 明矾用作净水剂,其原理为(用离子方程式表示).
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式;
(4)铁红是一种红色颜料,其成分是Fe2O3 , 将一定量的铁红溶于160mL5molL﹣1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+ , 参加反应的铁粉的质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com