
分析 (1)将海带灼烧再溶于水,得到含碘离子的水溶液,在酸性环境下用氧化剂将碘离子氧化为碘单质,进行检验即可;
(2)碘离子能被氧化为碘单质,碘单质遇到淀粉显示蓝色,据此回答.
解答 解:(1)证明海带中含有碘,步骤是:在坩埚中将海带灼烧再溶于水,得到含碘离子的水溶液,在酸性环境下用氧化剂将碘离子氧化为碘单质,根据碘单质遇到淀粉变蓝的现象,检验碘单质的生成,证明含有碘离子,则操作步骤为③①④②;
故答案为:③①④②;
(2)碘离子氧化为碘单质,滴入淀粉溶液,溶液变蓝,则证明含碘,H2O2是绿色氧化剂,可以将碘离子氧化,还原产物是水,即2I-+2H++H2O2=I2+2H2O.
故答案为:②;滴入淀粉溶液,溶液变蓝;2I-+2H++H2O2=I2+2H2O.
点评 本题考查物质的分离、提纯以及物质的检验,侧重于学生的分析、实验能力的考查,涉及过滤操作、氧化还原反应等,为高考常见题型,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 1 | 3 |
| 混合物的体积/g | 3.76 | 4.70 | 8.46 |
| 硫酸浓液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成一氧化碳的物质的量/mol | 0.03 | 0,0375 | 0.03 |
| A. | 样品中碳酸钾和碳酸氢钾的物成的量之比为1:2 | |
| B. | 样品中碳酸钾和碳酸氢钾的物质的量之比为2:3 | |
| C. | 所用硫酸的物质的量浓度为l.5mol•L-1 | |
| D. | 所用嫌酸的物质的量浓度为0.75mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

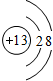 ,MgO的电子式
,MgO的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数a>b>c>d | |
| B. | 最高价氧化物对应水化物的碱性B>A | |
| C. | 单质还原性A>B>C>D | |
| D. | 离子半径D(n+1)->Cn->An+>B(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
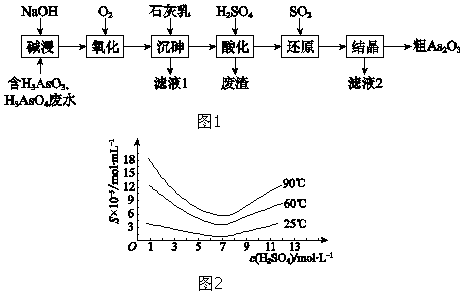
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和2:1的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com