
 S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业上常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:| S | CS2 | CCl4 | S2Cl2 | |
| 熔点/ | 113 | -109 | -23 | -77 |
| 沸点/ | 445 | 47 | 77 | 137 |
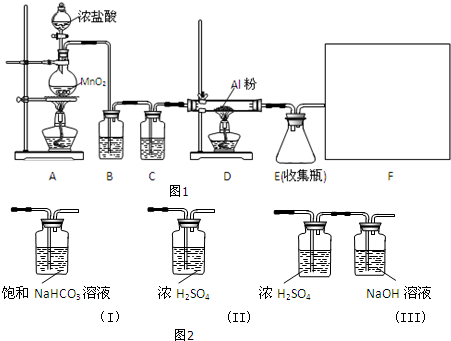
分析 制备S2Cl2原理是:在装置A中二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混油HCl和水,应该先用饱和食盐水除去HCl(装置B),再用浓硫酸干燥氯气(装置C),让氯气和二硫化碳在一定温度下发生反应(装置D):2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收.
(1)依据实验室制备氯气的方法分析,用二氧化锰和浓盐酸加热反应生成氯气;实验室也可以用高锰酸钾等强氧化剂和浓盐酸在常温下反应制取氯气;
(2)为充分冷凝,使冷水充满冷凝器,因此冷却水采取逆流原理;
(3)D中冷凝管起到导气和冷凝回流双重作用,根据各选项物质的制备实验结合装置的性质来回答;
(4)根据题干信息:S2Cl2在水中易发生岐化反应,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,
为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,用直接加热替代水浴加热,不易控制温度,温度高时产生副产物,产品纯度降低;
(5)M溶液吸收多余的氯气,氯化铁和氯气不反应,高锰酸钾和氯气也不反应;
(6)实验完毕后,分离产品需蒸馏,根据蒸馏操作选择玻璃仪器,蒸馏操作需要铁架台、酒精灯、石棉网、温度计、冷凝管、牛角管、锥形瓶等仪器.
解答 解:(1)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;如果撤去A装置中酒精灯,若想达到同样的目的,则圆底烧瓶中加入试剂是高锰酸钾(或重铬酸钾,氯酸钾)固体,如:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;高锰酸钾(或重铬酸钾,氯酸钾)固体;
(2)冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,所以冷却水从a口进入,
故答案为:a;
(3)D中冷凝管起到导气和冷凝回流双重作用,此作用在制取乙酸乙酯和溴苯、石油分馏的实验中用得到,实验室常用氯化铵固体和熟石灰固体混合加热来制取氨气2NH4C1+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,无需冷凝管,
故答案为:I、Ⅱ、Ⅳ;
(4)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,用直接加热替代水浴加热,不易控制温度,温度高时产生副产物,产品纯度降低,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑; 不易控制温度,温度高时产生副产物,产品纯度降低;
(5)M溶液吸收多余的氯气,氯气和水反应生成盐酸和次氯酸,盐酸和碳酸钠反应,所以能用碳酸钠吸收氯气,氯化铁、高锰酸钾和氯气不反应,不能选用,亚硫酸钠中+4价的硫能被氯气氧化,亚硫酸钠能作为吸收液,
故答案为:a、c;
(6)实验完毕后,分离产品需蒸馏,蒸馏操作需要铁架台、酒精灯、石棉网、温度计、冷凝管、牛角管、锥形瓶等仪器,则必需的主要玻璃仪器是:蒸馏烧瓶、温度计、冷凝管,
故答案为:蒸馏烧瓶、温度计.
点评 本题考查了氯气实验室制备方法,混合物分离的方法判断,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,离子方程式书写,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 50mL 2mol•L-1CaCl2溶液 | B. | 100mL 2mol•L-1NaCl溶液 | ||
| C. | 50mL 4mol•L-1CaCl2溶液 | D. | 100mL 4mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4m}{n}$ | B. | $\frac{22400m}{n}$ | C. | $\frac{22400n}{m}$ | D. | $\frac{n}{22.4m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.
在273K(即0℃)时,向如图所示的真空密闭容器A中充入0.5g H2时,测得容器内的压强为1.01×105Pa.由此可以判断A容器的体积约为5.6L.若向A中充入的是O2,压强也是1.01×105pa,则充入的O2质量是8g,若向A容器中充入的是C0气体,使容器内压强达到3.03×105Pa.则充入C0气体的质量是21g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 1 | 2 | 3 | 4 |
| V( 样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)(终读数) | 22.60 | 22.25 | 22.05 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是( )| A. | X为直流电源的负极,Y为直流电源的正极 | |
| B. | 阳极区pH增大 | |
| C. | 阴极区的电极反应为:2H++2e=H2↑ | |
| D. | 该过程中可以循环利用的物质是Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 28种 | C. | 32种 | D. | 40种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水扑灭 | |
| B. | 中和滴定实验中,滴定管、锥形瓶用蒸馏水洗净后须再用待装液润洗后方可使用 | |
| C. | 取少量硫酸亚铁铵晶体放入试管,加入适量NaOH溶液,加热试管,在试管口用湿润的蓝色石蕊试纸检验,则可证明硫酸亚铁铵晶体的成分中含有NH4+ | |
| D. | 探究反应速率影响因素的实验中,以Na2S2O3溶液与稀硫酸反应产生沉淀的快慢为依据来比较不同条件下速率的快慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com