
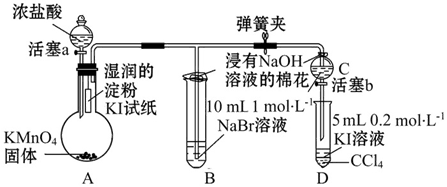
 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.分析 (1)A中产生黄绿色气体为Cl2,氯气是含有共价键的物质;
(2)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘;
(3)根据氧化剂的氧化性大于氧化产物的氧化性;
(4)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘的存在;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰.;
(6)从原子结构(电子层数、原子半径)的角度分析.
解答 解:(1)因KMnO4与浓HCl反应可以用来制Cl2,其电子式为: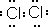 在该反应中浓盐酸表现了酸性和还原性.
在该反应中浓盐酸表现了酸性和还原性.
故答案为: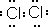 ;还原;酸
;还原;酸
(2)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝;
故答案为:淀粉KI试纸变蓝;
(3)因Cl2的氧化性大于Br2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(4)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,要发生:Cl2+2I-=I2+2Cl-,同时检验产物碘的存在;
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡,静置后CCl4层溶液变为紫(或紫红)色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱;
故答案为:电子层数依次增多,原子半径逐渐增大.
点评 本题主要考查了卤素单质氧化性的相对强弱的验证,使学生根据已知知识能得出实验现象并进行解释.


科目:高中化学 来源: 题型:解答题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
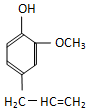 某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答:
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂.它的结构简式如图所示,请回答: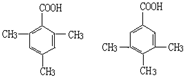 中的一种.
中的一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com