
|
使 1 mol CH4与Cl2发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗Cl2为 | |
| [ ] | |
A. |
0.5 mol |
B. |
2 mol |
C. |
2.5 mol |
D. |
4 mol |
科目:高中化学 来源:福建省四地六校联考2011届高三第三次月考化学试题 题型:022
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)500℃时,
在体积为1 L的容积固定的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.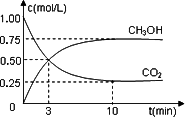
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol·L-1·min-1.
②该反应的平衡常数K=________(保留一位小数),平衡时H2的转化率为________.
③已知温度升高,K值减小.下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应
CH3OH(g)+②
甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入________极(填“正”或“负”),正极发生的电极反应为________.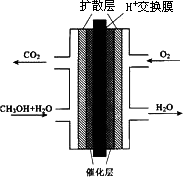
查看答案和解析>>
科目:高中化学 来源:河北省魏县第一中学2010-2011学年高二上学期第一次月考化学试题 题型:013
|
下列有关反应热的说法中正确的是 | |
| [ ] | |
A. |
一个化学反应是否能在常温下发生与该反应的ΔH值的大小没有必然联系 |
B. |
中和热ΔH=-57.3 kJ·mol-1,所以1.00 L 1.00 mol·L-1 H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量 |
C. |
用等体积的0.50 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液进行中和热测定的实验,会使测得的值偏大 |
D. |
在101 KPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
查看答案和解析>>
科目:高中化学 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
(1)一定条件下,2SO2(g)+O2(g) 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
(2)用CH4催化还原NOx为N2可以消除氮氧化物的污染.现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为________.
(3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
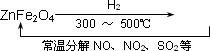
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x=________.求可分解(2)中混合气体体积V(标准状况下).(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com