
下列有关化学用语或名称,表达错误的是( )
A.COCl2分子的结构式: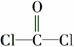
B.苯分子的比例模型:
C.碳正离子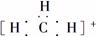 中质子数与电子数的比值为3∶2
中质子数与电子数的比值为3∶2
D.聚丙烯的结构简式为
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是( )
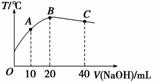
A.醋酸的电离平衡常数:B点>A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列10种物质:①明矾 ②消石灰 ③小苏打
④SiO2 ⑤水玻璃 ⑥聚乙烯塑料 ⑦CaO ⑧MnO2
⑨漂白粉 ⑩HClO
(1)属于纯净物的是______________,其中属于金属氧化物的是________,属于碱性氧化物的是____________,属于酸式盐的是__________,属于电解质的是__________。
(2)属于混合物的是__________,其中属于溶液的是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的变化叙述正确的是________。
①从海水中提取物质都必须通过化学变化来实现(2013·福建理综,6B)
②自行车钢架生锈主要是电化学腐蚀所致(2012·广东理综,7C)
③煤经过气化和液化等物理变化可以转化为清洁燃料(2013·山东理综,7B)
④“地沟油”禁止食用,但可以用来制肥皂(2013·福建理综,6D)
⑤232Th转化233U是化学变化(2013·上海,3C)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法不正确的是________(填字母)。
A.60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于碱性氧化物
B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2
D.液氨、液氯、液态氯化氢都是非电解质
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。
①1887年阿仑尼乌斯提出电离理论。
②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论:凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子的水溶液既可看作酸又可看作碱的是________(填字母)。
A.H2O B.NH C.OH- D.HCO
C.OH- D.HCO
E.CH3COO- F.Cl-
③1923年路易斯(Lewis)提出了广义的酸碱概念:凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [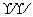 OH]- —→ H
OH]- —→ H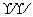 OH
OH
试指出下列两个反应中的酸或碱:
H3BO3+H2O===H++[B(OH)4]-
该反应中的碱是________(填“H3BO3”或“H2O”);
CuCl2+4NH3===[Cu(NH3)4]2++2Cl-
该反应中的酸是________(填“CuCl2”或“NH3”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.NaOH与CO2 B.Ba(OH)2与H2SO4
C.HC1与Na2 CO3 D.N aHCO3与C a(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.钠能与大多数非金属单质直接化合,生成其相应的化合物
B.钠与水的反应实际上是与水电离产生的H+的反应
C.钠在水溶液中参加的反应,都是先与水反应
D.钠不 能置换出盐溶液中的金属
能置换出盐溶液中的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要配制2mol/L的NaOH溶液950 mL,配制时应选用的容量瓶的规格和称量的NaOH的质量分别是( )
A.950 m L,76.0 g B.500 m L,80.0 g
C. 1000 mL,80.0 g D.1000 m L, 76.0g。
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示:
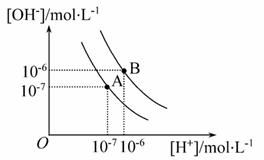
A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡到达B点。
(1)25℃时水的离子积为________,100℃时水的离子积为_________。
(2)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀 盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为__________。
盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com