
| ||
| A、氮化硅晶体属于分子晶体 |
| B、氮化硅中氮元素的化合价为-3 |
| C、上述反应中,N2是还原剂,SiO2是氧化剂 |
| D、上述反应中,每生成1mol Si3N4,N2得到6mol电子 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
 氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、Fe3+、Na+、SO
| ||
B、H+、Fe2+、CI-、NO
| ||
C、Ag+、Na+、CO
| ||
D、AI3+、K+、CI-、AIO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
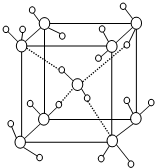 [化学-物质结构与性质]
[化学-物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LO2和N2的混合气体中分子总数为NA |
| B、常温常压下,1molI2固体中,含有I原子数为2NA |
| C、Na2O2与H2O反应生成16gO2时,转移电子数为NA |
| D、标准状况下,分子数均为NA的H2和H2O,它们所占的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A. | 向AgCl悬浊液中加入KI溶液,沉淀由白色变为黄色 | Ag++I-→AgI↓ |
| B. | 向Ba(OH)2溶液中滴加少量MgSO4溶液,产生白色沉淀 | Ba2++SO42-→BaSO4↓ |
| C. | 向Ca(HCO3)2 溶液中滴加少量澄清石灰水,产生白色沉淀 | Ca2++HCO3-+OH-→CaCO3↓+H2O |
| D. | 氯气溶于水得到淡黄绿色溶液 | Cl2+H2O?2H++Cl-+ClO- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2和NaHSO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、Ba(OH)2和NaHSO4:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| C、Ba(OH)2和KAl(SO4)2:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2- |
| D、Ba(OH)2和KAl(SO4)2:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6g组成为C2H6O的有机物,所含C-H键数目一定为0.6NA | ||||
| B、8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA | ||||
| C、0.1molN2与0.3molH2在密闭容器中,在催化剂作用下充分反应,生成氨分子数为0.2NA | ||||
D、在反应5NH4NO3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com