
【题目】下列各组物质中既有离子键也有共价键的是
A. CaCl2 B. Na2O C. NH3 D. NH4Cl
科目:高中化学 来源: 题型:
【题目】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是 . 工业上分离这些多氯代物的方法是 .
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式(不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下: ![]()
反应①的化学方程式为 , 反应类型为;反应②的反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.ΔH<0,ΔS>0的反应在温度低时不能自发进行
B.在其他条件不变时,增大反应物的浓度,可以增大活化分子百分数
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.NH4HCO3(g)===NH3(g) +H2O(g)+CO2(g) ΔH =+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器C的名称是 , 本实验所需玻璃仪器E规格和名称是 . 
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(5)如果定容时不小心超过刻度线,应如何操作 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=_____,C=_____,E=_____。
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式__________________________________________________。
(3)若t1<t2,则根据实验①和②得到的结论是_____________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,
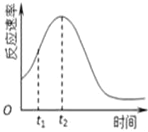
其中t1~t2时间内速率变快的主要原因可能是:
①__________________________________________;
②___________________________________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。该KMnO4溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。

(1)下列有关说法正确的是_____________。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是____________。
a.汽油 b.甲醇(CH3OH) c.甲醛(HCHO) d.乙酸(CH3COOH)
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H=﹣90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
CH3OH(g) △H=﹣90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO 、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
平衡常数 | K1 | K2 | K3 |
反应物转化率 | α 1 | α 2 | α 3 |

下列说法正确的是________________。
a.c1 = c2 b.2Q1 = Q3 c.K1 = K3 d.α2 + α3<100%
(4)某实验小组设计如图b所示的电池装置,正极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 烧结粘土制陶瓷涉及化学变化
B. 焊接时用NH4Cl溶液除锈
C. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃器皿上刻蚀标记
D. 轮船船底四周镶嵌铜块以保护船体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铵[(NH4)2CO3]室温下能自发地分解产生氨气,对其说法正确的是
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.该反应的ΔH-TΔS>0
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com