
| A、铝 | B、铁 | C、晶体硅 | D、金刚石 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
| ||
| ||
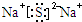
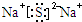
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
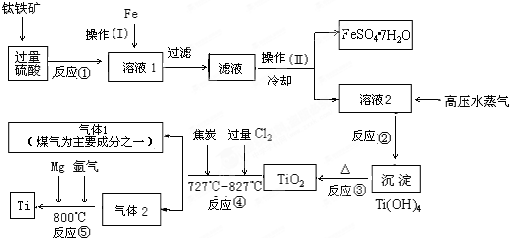
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:021
关于卤素的下列描述中正确的是
[ ]
A.若X表示卤素,则卤素单质与水反应的方程式可写成X2+H2O=HXO+HX
B.卤化银都是难溶于水的白色固体物质
C.通常用KI淀粉试纸来检验Cl2的存在
D.氯、溴、碘的单质在水中的溶解度远小于在有机溶剂里的溶解度
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省东北育才学校高一下学期期中考试化学试卷(带解析) 题型:填空题
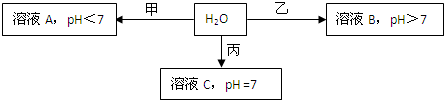
已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
(2)①甲的化学式是 ,乙的化学式可能是 (写一种即可)
②若W2-和Z-具有相同电子层结构,则乙的电子式是
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
①若以溶液C为电解质溶液时,正极的反应式为
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com