
| A. | Ag+、NO3-、Cl-、K+ | B. | Cu2+、NH4+、Br-、OH- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | K+、Ba2+、OH-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | H2O分子的中心原子形成sp2杂化轨道 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g NH3 | B. | 0.1mol NH4NO3 | C. | 6g NH4NO3 | D. | 13.2g (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

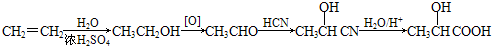
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
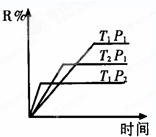 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com