
(12��)�к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�顣ȡ0.55 mol/L��NaOH��Һ50 mL��0.50 mol/L������50 mL����ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش���������
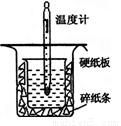
��1������ͼʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��_________ _������֮�⣬װ���е�һ�����Դ����� ��
��2�����õ�Ũ�ȵĴ�����NaOH��Һ��Ӧ�����õ��к�����ֵ��_________�����ƫ����ƫС�����䡱����
��3��ʵ���и���60 mL 0.50 mol��L��1�����50 mL 0.55 mol��L��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ������к��� (���ȡ�����ȡ�)���������ɣ� ��
��4��ijʵ��С�������������������Һ��������ʵ�飬ÿ��ȡ��Һ��50 mL������¼��ԭʼ���ݣ�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�(t2)/�� | �²�(t2��t1)/�� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00 g/cm3���кͺ���Һ�ı�����c��4.18��10��3 kJ/(g����)�����ݼ�������д�����кͷ�Ӧ���Ȼ�ѧ����ʽ ��
��1�����β����������С�ձ���δ��Ӳֽ���ס������ձ�����ֽ�������ˣ�δ��С�ձ�����㹻�ߣ�
��2��ƫС
��3����� ��Ϊ�����к���Ҫ���������1 mol H2O���ų����������������ᡢ��������أ�
��4��HCl��aq����NaOH��aq����NaCl��aq����H2O��l������H����56.85 KJ/mol��
��������
����������ⶨ�к���Ӧ����������������ʧ����ʹ�������ٳ�ַ�Ӧ����1����װ��ͼ���Կ���ȱ�ٻ��β����������С�ձ���δ��Ӳֽ���ס������ձ�����ֽ�������ˣ�δ��С�ձ�����㹻�ߣ��������������ʧ����2�����������ᣬ������̻��������������õ��к�����ֵ��ƫС����3���к�����ָ�к�����1 mol H2O���ų����������������ᡢ��������أ�����4�������������ݣ���ȥ��3�����ݣ�ȡǰ�������ݵ�ƽ��ֵ���м��㣬��Ӧ����ˮ�����ʵ���Ϊ0.050L��0.5m ol/L=0.025mol,�ų�������ΪQ=3.4���100g��4.18��10��3 kJ/(g����)=1.4212KJ,���к��ȡ�H����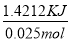 =��56.85 KJ/mol��
=��56.85 KJ/mol��
���㣺�к��ȵIJⶨ


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
������Ⱦ�ѳ�Ϊ����������ٵ��ش���в��������Ⱦ����ʤ�������и������뻷����Ⱦ�ص���
������ЧӦ �ڳೱ ������ �ܳ����ն� ��ˮٶ�� ���Ӳ� ��ˮ�� �ೱϫ
A���٢� B���ۢ� C���ݢ� D���ޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
������Դ���ķ�����
A������ B������ C���ѷ� D���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�︣��ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
�����ڼ����Ȼ��ء����ᡢ��������������Һ���Լ���
A��AgNO3��Һ B����ɫʯ����Һ
C��Na2CO3��Һ D�����۵⻯����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�︣��ʡ�߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
��ҵ�������ճ������У���μ��ٶ�����̼�ŷ��ѳ�Ϊȫ�����ע���ȵ㣬��̼���ú͵�̼�����Ϊ���Ż��⡣�����������̼Ҫ������Ӧ����
A��������ʹ��һ������ľ����
B������ú����磬�ӿ쾭�÷�չ
C������������Ͻ��ݶ���ǽ�棬�������̫��������
D���ᳫ�����г����˹���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�人�и߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£���ˮϡ��c mol��L��1��ϡ���ᣬ����Kw��ʾˮ�����ӻ�����������ֵ��ˮ�������Ӷ��������
A��c(H��)/c(OH��) B��c(CH3COOH)/c(H��)
C��c(CH3COO��)/c(CH3COOH) D��c(H��)/KW
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�人�и߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪���������л�ѧ����Ҫ���յ������ֱ�Ϊ��H��H 436 kJ/mol��F��F 153 kJ/mol��H��F 565 kJ/mol������˵����ȷ����
A��H2��F2��Ӧ���Ȼ�ѧ����ʽΪ��H2��g�� �� F2��g���� 2HF��g���� ��H �� ��541 kJ
B��2 L HF����ֽ��1 L H2��1 L F2����541 kJ������
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�����С��541 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�人�и�һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
��ǿ������Һ���ܴ����������������
A��K+��Na+��NO3����CO32��
B��K+��Na+��Br����SO32��
C��K+��Na+��I����SO42��
D��Na+��K+��CH3COO����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ���ݵ�����У��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣���1���ڱ�״���£�4��8g����(CH4)��ռ�����Ϊ_________L�������״����________L����(H2S)������ͬ��Ŀ����ԭ�ӣ�
��2���������ļ�����笠������ĵ�����֮��___ ___��������֮�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com