
 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据下图回答:从t2→t3的曲线变化是由哪种条件引起的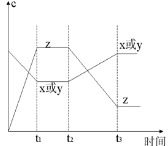
| A.增大X或Y的浓度 |
| B.增大压强 |
| C.增大Z的浓度 |
| D.升高温度 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:单选题
 4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g),△H﹥0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是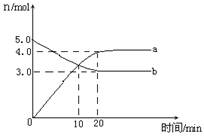
| A.10min时,反应达到平衡 |
| B.该温度下反应的平衡常数为8 |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g) +I2(g). 在
H2(g) +I2(g). 在| A.HI的分解速率小于其生成速率 | B.HI的分解速率等于其生成速率 |
| C.HI的分解速率大于其生成速率 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。| A.①、③和⑥ | B.②、③和⑥ | C.①、④和⑥ | D.②、③、⑤和⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表: | 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
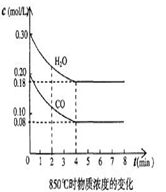
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( )
2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( )| A.X2为0.4mol·L—1,Y2为1.2mol·L—1 | B.Y2为1.0mol·L—1 |
| C.X2为0.3mol·L—1,Z为0.2mol·L—1 | D.Z为0.6mol·L—1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com