
(16分)某化学兴趣小组在进行钠在空气中燃烧的实验,请写出钠在氧气中燃烧的化学方程式: 。实验后,同学们发现除了得到黄色物质外,产物中还有黑色物质。兴趣小组的同学对产生的黑色固体物质进行实验探究。
查阅资料:
工业上采用铁环作阴极电解得到金属钠。实验室中金属钠的标签主要内容如下: 
提出猜想:
猜想1:钠附着煤油,煤油的不完全燃烧可以生成碳单质;猜想2: 与钠反应也可以生成碳单质;
猜想3: ; 猜想4:……
设计实验方案,验证猜想:
| 实验目的 | 实验步骤 | 实验现象 | 结论 |
| 验证猜想1 | 将一小块钠从煤油中直接取出加热燃烧 取出一小块切去表皮并擦干净煤油的钠加热燃烧 | | 黑色物质中含 有碳单质 |
| 验证猜想3 | | | 黑色物质中 含有铁元素 |
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:单选题
以下进行性质比较的实验设计,不合理的是
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L¯1NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1) ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2) 用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。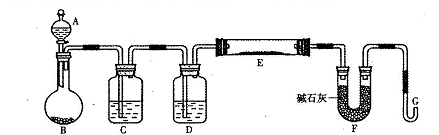
请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是__ __;
(3)试剂D是__ __,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是_ __(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g) △H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s) △H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行
次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。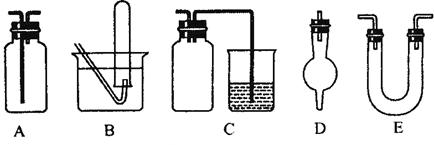
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有__________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察 来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是 ;
若不采用A同学的改进方案,你认为还可以如何改进? 。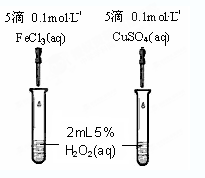
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com