
分析 (1)Zn、Cu和稀硫酸构成原电池,Zn易失电子作负极、Cu作正极,电池反应式为Zn+H2SO4=ZnSO4+H2↑,根据H守恒计算硫酸的物质的量浓度;
(2)如果将电解质溶液改为硫酸铜溶液,则电池反应式为Zn+CuSO4=ZnSO4+Cu,负极上溶解Zn、正极上析出Cu,两个电极的质量差等于溶解的Zn和析出Cu的质量,根据方程式知,溶解锌和析出Cu的物质的量相等,再根据溶解Zn和转移电子之间的关系式计算.
解答 解:(1)n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,Zn、Cu和稀硫酸构成原电池,Zn易失电子作负极、Cu作正极,电池反应式为Zn+H2SO4=ZnSO4+H2↑,根据H守恒得n(H2SO4)=n(H2)=0.15mol,
则c(H2SO4)=$\frac{0.15mol}{0.2L}$=0.75mol/L,
答:原硫酸的物质的量浓度为0.75mol/L;
(2)如果将电解质溶液改为硫酸铜溶液,则电池反应式为Zn+CuSO4=ZnSO4+Cu,负极上溶解Zn、正极上析出Cu,两个电极的质量差等于溶解的Zn和析出Cu的质量,根据方程式知,溶解锌和析出Cu的物质的量相等,设溶解锌和析出Cu的物质的量分别为xmol,则64xg+65xg=2.58g,x=0.02,
根据Zn和转移电子之间的关系式知,转移电子物质的量=2n(Zn)=2×0.02mol=0.04mol,
答:若将电解质溶液改为硫酸铜溶液,当电池两极的质量差为2.58g时,从电池中流出的电子的物质的量为0.04mol.
点评 本题以原电池原理为载体考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意(2)题反应后两极质量差为“溶解锌的质量和析出铜质量之和”而不是“溶解锌和析出铜质量之差”,为易错题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 高级脂肪酸甘油酯的碱性水解叫皂化反应 | |
| B. | 含淀粉或纤维素的物质可以酿酒 | |
| C. | 鸡蛋清的溶液中加入饱和氯化钠溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
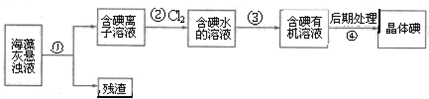
| A. | 步骤①、③的操作分别是过滤、萃取分液 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L•min | B. | 0.6 mol/(L•min) | C. | 0.9 mol/(L•min) | D. | 1.2 mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2SO4能溶于水 | |
| B. | LiOH是易溶于水、受热不分解的强碱 | |
| C. | Li遇浓硫酸不产生“钝化”现象 | |
| D. | Li2CO3受热分解,生成Li2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯和水,苯和水 | B. | 乙酸乙酯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水 | D. | 醋酸和水,甲苯和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com