
NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:

请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10?39)。下列说法正确的是______(选填序号)。
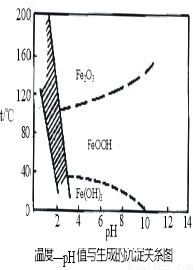
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol?L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③ ;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干。
(1)容量瓶 胶头滴管
(2)S2-+Cu2+= CuS↓
(3)cd
(4)Na2SO4 NiSO4
(5)上层清液呈无色
(6) ①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加6 mol/L的H2SO4溶液,直至恰好完全溶解
③蒸发浓缩、冷却结晶并从溶液中分离出晶体.
【解析】
试题分析:(1)用浓硫酸配制一定物质的量浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有容量瓶 胶头滴管;(2)Na2S是可溶性盐,溶于水时电离出S2ˉ,S2ˉ与Cu2+易反应生成CuS沉淀,离子方程式为S2-+Cu2+= CuS↓;(3)a.FeOOH中铁为+3价,错误;b.根据25℃时Fe(OH)3的Ksp = c(Fe3+) c3(OH-) =2.64×10?39,pH=4时,c(OH-) =10?10除去铁,此时溶液中c(Fe3+)=2.64×10?9,错误;c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,正确;d.分析图像知,工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8,正确;选cd;(4)分析流程图知,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液1的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液II的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Na2SO4;(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是上层清液呈无色(6)从NiSO4、Na2SO4及硫酸的混合溶液中制取NiSO4?6H2O晶体,需要蒸发浓缩、冷却结晶并从溶液中分离出晶体。
考点:考查化学工艺流程、物质的制备。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、SO2、NO或CO2都会导致酸雨的形成 | B、氯比硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料 | C、甲醛的含量属于食品安全检测的指标 | D、液氯罐泄漏时,可将其移入水塘中并加入生石灰 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向无色溶液中滴加氯水和CCl4,振荡静置 | 下层溶液显紫色 | 溶液中含有I- |
B | 过量铁粉加入稀硝酸中充分反应,再加入 KSCN溶液 | 溶液呈红色 | 稀硝酸将铁氧化为Fe3+ |
C | 向淀粉溶液中滴加稀硫酸,加热,取出水 解液少许,滴加银氨溶液,并水浴加热 | 没有银镜出现 | 淀粉没有发生水解 |
D | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
在相同条件下,下列各组物质中,分子数一定相同的是
A、34g NH3和4g H2 B、14g N2和32g O2
C、2L CO2和2L H2O D、11.2L O2和0.5mol H2
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
下列物质中,属于电解质的是
A、氯化钠溶液 B、二氧化碳 C、氢氧化钠固体 D、铁
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列有关溶液中微粒浓度关系的叙述正确的是
A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
B.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3—)+c(H2CO3)+c(CO32—)
C.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
D.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)=c(NH4+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,71g Cl2中含有的氯原子数目为NA
B.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
C.46 g 由NO2与N2O4组成的混合气体含有的原子数目为3NA
D.1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g) + HCl(g) NH4Cl(s)在室温下可自发进行,则该反应的△H<0
NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中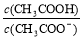 的值增大
的值增大
D.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列相关反应的离子方程式书写正确的是
A.4molFe在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3
B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
C.Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com