
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
【知识点】氧化还原反应的有关概念B2 B3
【答案解析】D 解析:根据方程式,氧化产物和还原产物都是氮气,假设氧化产物有15摩尔,则还原产物有1摩尔,
10NaN3+2KNO3= K2O+5Na2O+15N2↑(氧化产物)+1N2↑(还原产物) △n
15 1 14
X y 1.75
解得:x=1.875 y=0.125
A、生成N2标准状况下的体积是(1.875+0.125)mol×22.4L/mol=44.8L,故A错误;B、KNO3被还原,故B错误;C、转移电子的物质的量为0.125×2×5=1.25mol ,故C错误;D、被氧化的N原子的物质的量为1.875mol×2=3.75mol,故D正确。
故答案选D
【思路点拨】本题考查了氧化还原反应的有关概念,氧化产物和还原产物都是氮气,关键是找到氧化产物和还原产物的关系。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
、将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.则下列叙述中不正确的是( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL
B.当金属全部溶解时收集到NO气体的体积一定为2.24L
C.参加反应的金属的总质量为9.6g>m>3.6g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关的离子方程式书写正确的是
A.NaHS溶液水解: HS- + H2O 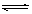 S2- + H3O+
S2- + H3O+
B.向Ca(C1O)2溶液中通入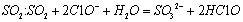
C.硫酸与氢氧化钡溶液混合: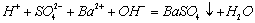
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
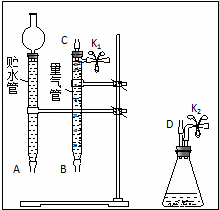
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目: 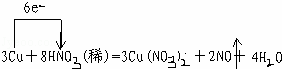 .
.
②设计实验方案:在 相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度) 下,测定 相同时间内产生气体体积(或产生相同体积的气体所需的时间) .
③在答卷的图中将A、B、C、D、几处用橡胶管
以正确方式连接起来,以测定反应所产生气体的
体积(三个容器中的液体和水都已画出).
④测定前,为避免NO被氧化为NO2,要用CO2
排出锥形瓶和橡胶管中的空气:装入铜片、松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是 松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止 .
(2)在K2处注入硝酸发生反应.在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:
| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组对离子方程式xR2+ + yH+ + O2 = mR3+ + nH2O的分析研究,下列说法中错误的是
A.根据电荷守恒,得出x与y的和一定等于m
B.根据原子守恒,得出x和m的数值一定相等
C.根据电子得失守恒,得出x=4的结论
D.根据氧化还原反应关系得出:R2+是还原剂, O2是氧化剂, R3+是氧化产物, H2O是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基钠和氢化钠与水反应的化学方程式如下:
①NaNH2+H2O=NaOH+NH3↑ ② NaH+H2O=NaOH+H2↑。下列叙述正确的是
A.方程式②中,每生成1mol H2转移2 mol电子
B.①和②两个反应都是氧化还原反应
C.氨基钠和氢化钠与盐酸反应都只生成一种盐
D.氨基钠和氢化钠晶体中都有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应:2Mn2++5 S2O82-+8X=2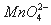 +10 SO42-+16H+,下列说法正确的是
+10 SO42-+16H+,下列说法正确的是
A.X是H2O
B.还原性:SO42-> Mn2+
C.该反应中酸性介质可以为盐酸
D.每生成0.1mol SO42-,转移电子0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别下列各组有机物所用试剂及现象均正确的是 ( )
| 选项 | 有机物 | 鉴别所用试剂 | 现象与结论 |
| A | 葡萄糖与果糖 | 钠 | 有气体放出的是葡萄糖 |
| B | 麦芽糖与蛋白质 | 溴水 | 褪色的是麦芽糖 |
| C | 油脂与蛋白质 | 浓硝酸 | 变蓝的是蛋白质 |
| D | 淀粉与蛋白质 | 碘水 | 变蓝的是淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列化合物的名称或结构简式:
①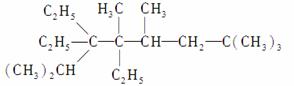
________________________________________________________________________,
②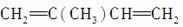 ________________________________________________________________________,
________________________________________________________________________,
③CH2===CHCOOH________________________________________________________________________,
④2,5二甲基 2,4己二烯的结构简式:
________________________________________________________________________
________________________________________________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如下: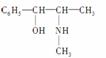
①麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
②下列各物质:
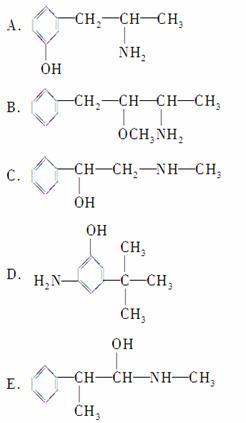
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com