
分析 (1)1个硫酸分子含有2个氢原子,硫酸为强电解质完全电离;
(2)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,结合氨气含有3个氢原子,水分子含有2个氢原子解答;
(3)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$计算解答;
解答 解:(1)0.1mol H2SO4约含氢原子数目:0.1mol×2×NA=0.2NA,硫酸为强电解质完全电离,1mol硫酸电离产生1mol硫酸根离子,所以0.1mol硫酸溶于水后电离出 0.1mol SO42-;
故答案为:0.2NA,0.1;
(2)$\frac{34g}{17g/mol}$×3=$\frac{m}{18g/mol}$×2,解得m=54g;
故答案为:54;
(3)标准状况下33.6L氧气的质量n=$\frac{33.6L}{22.4L/mol}$×32g/mol=48g;相同条件下气体的体积之比等于物质的量量之比,所以与它体积相同的甲烷的物质的量是:$\frac{33.6L}{22.4L/mol}$=1.5mol;
故答案为:48g;1.5mol.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式是解题关键,注意物质的结构组成,注意气体摩尔体积使用条件和对象.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液本质区别是有无丁达尔效应 | |
| B. | 均一稳定的分散系只有溶液 | |
| C. | 只有胶状物质如胶水、果冻才能称为胶体 | |
| D. | 一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 碳酸钙与稀硝酸的反应:CO32-+2H+═CO2+H2O | |
| C. | 铜与稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋加入热水瓶中除去水垢 | ||
| C. | 蛋壳浸泡在白醋中有气体放出 | D. | pH试纸显示白醋的pH为2~3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
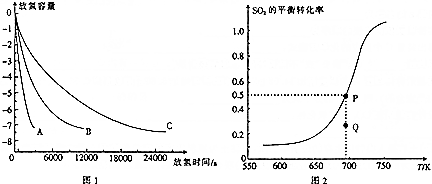
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
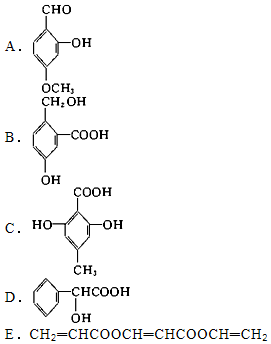
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com