
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:____________________
(2)配平该方程式____FeC2O4·H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式______;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
【答案】![]() 2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液.若溶液呈血红色则晶体中含有铁元素,反之则无(其他合理也可)
2 1 3 1 2 H2C2O4+H2O2=2CO2↑+2H2O 否 取适量晶体加热,将加热后的固体残留物溶解在稀硫酸中,滴加KSCN溶液.若溶液呈血红色则晶体中含有铁元素,反之则无(其他合理也可)
【解析】
(1)H2O2为共价化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据水的个数的最小公倍数为6,则FeC2O42H2O的化学计量数为2,K3[Fe(C2O4)3]3H2O的化学计量数3,然后由原子守恒可知,该化学反应为2FeC2O42H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe(C2O4)3]3H2O,故答案为:2;1;3;1;2;
(3)草酸被H2O2氧化生成水和二氧化碳,该反应为H2C2O4+H2O2=2CO2↑+2H2O,故答案为:H2C2O4+H2O2=2CO2↑+2H2O;
(4)因Fe3++3C2O42-= [Fe(C2O4)3]3-,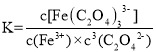 =1020,配合物的稳定性可以用稳定常数K来衡量,K值越大说明生成的配合物越稳定,已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
=1020,配合物的稳定性可以用稳定常数K来衡量,K值越大说明生成的配合物越稳定,已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,说明[Fe(C2O4)3]3—远远比Fe(SCN)3稳定,向K3[Fe(C2O4)3]·3H2O溶液中加入KSCN溶液,[Fe(C2O4)3]3—中的Fe3+不能与SCN-反应转化为Fe(SCN)3,也就不能显示血红色。无法验证铁元素;检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;
103,说明[Fe(C2O4)3]3—远远比Fe(SCN)3稳定,向K3[Fe(C2O4)3]·3H2O溶液中加入KSCN溶液,[Fe(C2O4)3]3—中的Fe3+不能与SCN-反应转化为Fe(SCN)3,也就不能显示血红色。无法验证铁元素;检验铁元素的方案为取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;
故答案为:否;取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液.若溶液呈血红色则有铁元素,反之则无;


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
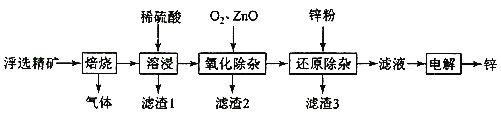
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
请回答下列问题:
(1)焙烧过程中产生的气体化学式__。
(2)溶浸时,提高浸出率的方法有____。(至少写出两种)
(3)利用Fe(OH)3悬浊液与含SO2的烟气反应生成FeSO4,可以使烟气脱硫,该反应的离子方程式为__。产物FeSO4在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__。
(4)氧化除杂时,加入ZnO调节溶液pH,当用广泛pH试纸测得pH值为___时,可认为已达除杂目的。
A.2 B.2.8 C.4 D.6.2
(5)滤渣3成分为______。
(6)若将闪锌矿直接浸入稀硫酸,要使0.10 molZnS完全溶于1LH2SO4(发生反应ZnS+H2SO4 =ZnSO4+H2S),则需H2SO4的最低浓度为___。(Ksp[ZnS]=2.5×10-22,H2S的K1=1×10-7,K2=1×10-14,忽略反应前后液体体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g) ![]() Ng)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,下列判断不正确的是
Ng)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,下列判断不正确的是
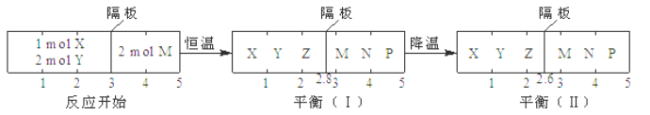
A. 反应①的正反应是放热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
C. 达平衡(I)时,X的转化率为20%
D. 在平衡(I)和平衡(II)中,M的体积分数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应aX(g)+bY(g)=cZ(g)+dW(g),反应达到平衡后,保持温度不变,将容积扩大到原来的2倍,当再次达到平衡时,W的浓度为原平衡时的3/5,下列叙述正确的是( )
A. 平衡向逆反应方向移动 B. a+b<c+d
C. X的体积分数增大 D. X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
选项 | a | b | c | 现象 | 结论 | 装置 |
A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 |
|
B | 浓盐酸 | MnO2 | 石蕊试液 | 石蕊试液先变红后褪色 | 氯气具有漂白性 | |
C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH溶液反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二元化合物A是一种较强的还原剂,可以用次氯酸钠溶液和过量的氨气制得,64gA完全燃烧得到4.48L密度为1.25g·L—1的气体B(体积与密度均在标准状况下测定)。
(1)A的化学式___________________。
(2)写出次氯酸钠溶液和过量的氨气制备A的离子方程式_________________________。A的制备过程中氨气需要过量的理由是_____________________________________。
(3)A可与黑色的CuO反应生成气体B和一种砖红色的物质,写出该化学方程式__________。
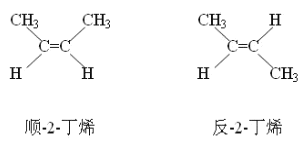
(4)已知2一丁烯存在顺反异构(如下图所示),甲基在双键同一侧的,称为顺式:甲基在双键两侧的,称为反式。现有化合物C,所含元素与A相同,摩尔质量小于A,C可通过A与等物质的量的过氧化氢恰好完全反应得到。实验表明,C可能存在两种结构,请写出它们的结构式_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
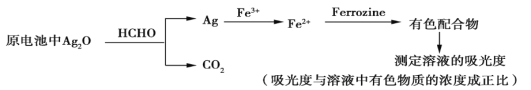
A. 其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B. 电池正极的电极反应式为Ag2O+2H++2e-![]() 2Ag+H2O
2Ag+H2O
C. 30 g HCHO被氧化时,理论上电路中通过2 mol电子
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度低于570℃ 时,还原铁粉与水蒸气反应的产物是FeO;高于570℃ 时,生成Fe3O4。老师用下图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
试回答下列问题:
(1)湿棉花的作用是______________。
(2)写出高于570℃ 时,Fe 与水蒸气反应的化学方程式:___________。
(3)乙同学认为加入KSCN 溶液没有出现血红色的原因可能是固体中没有Fe3O4,也有可能是因为___(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN 溶液时没有出现血红色,该反应的离子方程式是______________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH 溶液后,观察到的实验现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如图:下列有关香叶醉的叙述正确的是( )

A. 香叶醇的分子式为C10H18O
B. 不能使溴的四氯化碳溶液褪色
C. 不能使酸性高锰酸钾溶液褪色
D. 能发生加成反应不能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com