


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C同在B的下一周期,C的电离能数据(kJ?mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.硅原子和钠原子 B.硼原子和氦原子 C.氯原子和碳原 D.碳原子和铝原子
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )
A.硅原子和钠原子 B.硼原子和氦原子
C.氯原子和碳原 D.碳原子和铝原子
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。

(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示
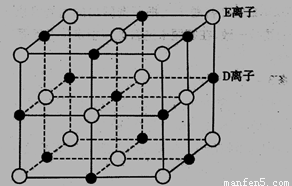
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com