
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.5mol/(L·min) | B.0.15mol/(L·min) |
| C.0.75mol/(L·min) | D.0.075mol/(L·min) |
查看答案和解析>>
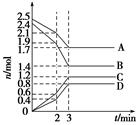
科目:高中化学 来源:不详 题型:单选题
 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: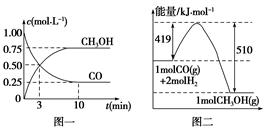
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.X2+2Y2 2XY2 2XY2 | B.2X2+Y2 2X2Y 2X2Y |
C.X2+3Y2 2XY3 2XY3 | D.3X2+Y2 2X3Y 2X3Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )| A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com