
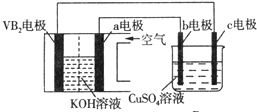
| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
分析 硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:4VB2+11O2═4B2O3+2V2O5,则与负极相连的c为电解池的阴极,铜离子得电子发生还原反应,与氧气相连的b为阳极,氢氧根失电子发生氧化反应,以此解答该题.
解答 解:A.电解过程中,c为阴极,发生还原反应,先生成铜,后生成氢气,故A正确;
B.外电路中电子由VB2电极流向阴极c电极,故B错误;
C.负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故C错误;
D.当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即$\frac{0.448L}{22.4L/mol}$=0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为$\frac{0.04-0.01×2}{2}$=0.01mol,则CuSO4溶液的物质的量浓度为$\frac{0.01}{0.1}$=0.1mol/L,故D错误.
故选A.
点评 本题考查原电池及其电解池的工作原理,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意把握电极反应式的书写,利用电子守恒计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1MgCl2溶液 | B. | 0.1mol•L-1NH4Cl溶液 | ||
| C. | 0.1mol•L-1KCl溶液 | D. | 0.1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaHS溶液中滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大 | |
| B. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| C. | 0.1 mol•L-1 Na2SO3溶液加入少量NaOH固体,c(SO32-)与c(Na+)均增大 | |
| D. | 常温下pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质量的H2O和CO2所含原子数均为3NA | |
| B. | 1mol由Na2O和Na2O2组成的混合物中,含有的离子数为3.5NA | |
| C. | 1L 12mol•L-1浓盐酸和足量MnO2在加热条件下充分反应,生成的气体的分子数为3NA | |
| D. | 标准状况下,6.72L NO2通入足量的水中,转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com