
两种元素可以形成AB2型共价化合物的是
A.无中子的原子与最外层有6个电子的短周期元素的原子
B.核电荷数分别为12和17的元素
C.ⅣA族和ⅥA族原子半径最小的元素
D.最高正价都为奇数的两种短周期元素
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
A.H2O2的分解反应为放热反应
B.FeCl3是H2O2分解反应的催化剂
C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多
D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K为 。
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
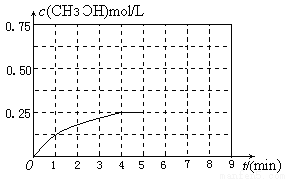
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)= 0.2 mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列方法中可以证明2HI(气)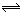 H2(气)+I2(气)已达平衡状态的是
H2(气)+I2(气)已达平衡状态的是
① 单位时间内生成n mol H2的同时生成n mol HI
② 一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④ 反应速率υ(H2)=υ(I2)=0.5υ(HI)时
⑤ c(HI)=c(H2)=c(I2)=2:1:1
⑥ 温度和体积一定时,某一生成物浓度不再变化
⑦ 温度和体积一定时,容器内压强不再变化
⑧ 条件一定,混合气体的平均相对分子质量不再变化
⑨ 温度和体积一定时混合气体的颜色不再变化
A. ②③④⑤⑥ B. ②⑥⑦⑧⑨ C. ①②⑥⑧ D. ②⑥⑨
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成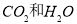
③石油的分馏、煤的气化和液化都是物理变化。
④淀粉和纤维素水解的最终产物都是葡萄糖
⑤将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag
⑥除去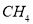 中的少量
中的少量 ,可将混合气体通过盛有溴水的洗气瓶
,可将混合气体通过盛有溴水的洗气瓶
A.③⑤⑥ B.④⑤⑥ C.①②⑤D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是
A.乙烯聚合为聚乙烯高分子材料 B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜 D.用二氧化硅制备高纯硅
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,正确的是

A.加NaOH,HA电离平衡常数增大
B.通入HCl,溶液中阴离子浓度之和减小
C.溶液中水的电离程度a>b>c
D.b点溶液中,c(HA)<c(A-)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:填空题
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3?10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
键 | H-H | N-H | N-N | N=N | N≡N |
键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
在100 mL某混合酸中,c(HNO3)=0.4 mol·L-1,c(H2SO4)=0.1 mol·L-1,向其中加入1.92 g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
A.0.15 mol·L-1 B.0.30 mol·L-1 C.0.225 mol·L-1 D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com