
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
分析 相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C都是10电子,D为18电子,应是H与O或H与N形成的微粒,H与O形成的微粒A、B、C、D为分别为:OH-、H2O、H3O+、H2O2,H与N形成的微粒A、B、C、D为分别为:NH2-、NH3、NH4+、N2H4,B1的沸点比B2高,故B1为H2O,B2为NH3,故:
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)上述元素中O元素非金属性最强;
(2)Na与NH3(l)反应生成NaNH2、H2;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,碘遇淀粉变蓝色,加入淀粉作指示剂,进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点;
令样品的纯度为a,则NaClO2•3H2O的质量质量为0.2ag,根据关系式NaClO2•3H2O~2I2~4S2O32ˉ列方程计算.
解答 解:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多,A、B、C都是10电子,D为18电子,应是H与O或H与N形成的微粒,H与O形成的微粒A、B、C、D为分别为:OH-、H2O、H3O+、H2O2,H与N形成的微粒A、B、C、D为分别为:NH2-、NH3、NH4+、N2H4,B1的沸点比B2高,故B1为H2O,B2为NH3,故:
H与O形成的微粒为第一组,则:A1为OH-,B1为H2O,C1为H3O+,D1为H2O2;
H与N形成的微粒为第二组,则:A1为NH2-,B2为NH3,C2为NH4+,D2为N2H4;
(1)上述元素中O元素非金属性最强,处于周期表中第二周期第VIA族,
故答案为:第二周期第VI族;
(2)Na与NH3(l)反应生成NaNH2、H2,反应方程式为:2Na+2NH3(l)=2NaNH2+H2↑,
故答案为:2Na+2NH3(l)=2NaNH2+H2↑;
(3)①由题目可知,ClO2气体通入H2O2和NaOH的混合液中生成NaClO2,Cl元素化合价降低,被还原,故H2O2发生氧化反应生成O2,同时有水生成,反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2,反应中H2O2是还原剂,
故答案为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2;还原剂;
②由流程图可知,ClO2-在酸性条件下氧化I-生成I2,ClO2-被还原为Cl-,同时生成H2O,反应离子方程式为:ClO2-+4I-+4H+=2I2+Cl-+2H2O,
碘遇淀粉变蓝色,加入淀粉作指示剂,
进行滴定,当溶液由蓝色变无色,且半分钟不变色现象时,达到滴定终点,
令样品的纯度为a,则NaClO2•3H2O的质量质量为0.2ag,则:
NaClO2•3H2O~2I2~4S2O32ˉ
144.5g 4mol
0.2ag 0.2mol/L×0.025L
所以144.5g:0.2ag=4mol:0.2mol/L×0.025L
解得a=90.3%
故答案为:ClO2-+4I-+4H+=2I2+Cl-+2H2O;淀粉;溶液由蓝色变无色,且半分钟不变色;90.3%.
点评 本题考查物质推断、化学用语、氧化还原反应滴定、化学计算等,难度较大,推断物质是解题的关键,注意掌握常见10电子、18电子微粒.


科目:高中化学 来源: 题型:选择题
| A. | 在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| B. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| C. | 在燃煤时加入适量石灰石粉末,可减少SO2的排放:CaCO3+SO2═CaSO3+CO2 | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和银 | B. | 铁和锌 | C. | 铝和铁 | D. | 镁和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可以制取Fe(OH)3胶体 | |
| C. | 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加到过量时,沉淀也不会消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(H+)=10-12 mol/L的溶液中:K+、Na+、Fe2+、NO3- | |
| B. | 在c(H+)=$\sqrt{{K}_{W}}$mol/L的溶液中:K+、Fe3+、HCO3-、AlO2- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、SO42-、Cl- | |
| D. | pH=13的溶液中:NH4+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
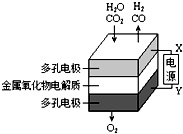 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com