
目前在水的净化处理、纸浆的加工等化学工艺中普遍用到一种高分子化合物聚丙烯酰胺。它可由化合物A(分子式C3H6)经以下反应流程制得:
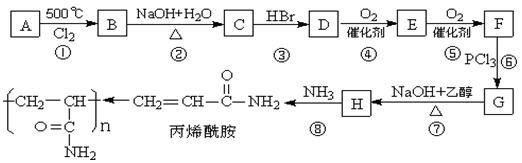
已知:(1)3RCOOH+PCl3![]() 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3![]() RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)写出A和H的结构简式A ,H 。
(2)关于丙烯酰胺的下列叙述中正确的是: 。
A.能使酸性KMnO4溶液褪色; B.能发生加聚反应生成高分子化合物;
C.与α—氨基乙酸互为同系物; D.能与H2发生加成反应
(3)写出D→E的反应方程式: 。
(4)C→D的目的是 。
(5)上述反应过程中属于取代反应的是: 。
(6)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种:
①链状,无碳碳叁键; ②同一个碳原子上不能连有2个双键。
试写出其中的2种的结构简式: 、 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:

①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com