
图示中的四种物质W、X、Y、Z,能按箭头方向一步转化的有
| W | X | Y | Z |
| |
| ① | Na | NaOH | Na2CO3 | NaCl | |
| ② | Al(OH)3 | Al2O3 | Al | NaAlO2 | |
| ③ | SO2 | (NH4)2SO3 | NH4HSO3 | Na2SO3 | |
| ④ | FeCl2 | Fe | FeSO4 | FeCl3 |
A.①②③④ B.①②③ C.①③ D.②④
科目:高中化学 来源: 题型:
化学与生活密切相关,下列有关说法正确的是( )
A.糖类、蛋白质、油脂都属于天然高分子化合物
B.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
C.葡萄糖、蔗糖和淀粉都能发生水解反应
D.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑥根据Na2O、Na2O2组成元素相同,均与H2O反应,故均属于碱性氧化物
A.②⑥ B.②⑤ C.①②⑤⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO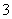 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
A.Cl2和苛性钾溶液在不同温度下可能发生不同反应
B.反应中转移电子数为是0.21 NA
C.原苛性钾溶液中KOH的物质的量无法确定
D.生成物中Cl- 的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Ca2+、K+、HCO3-、Cl-
C.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
草木灰中可能含K2CO3、K2SO4及NaCl等盐,将草木灰用蒸馏水浸取得浸取液进行实
验,下列根据现象得出的结论不正确的是
A.向浸取液中加入BaCl2有白色沉淀,说明其中含有SO42-
B.向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl-
C.洁净的铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+
D.向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
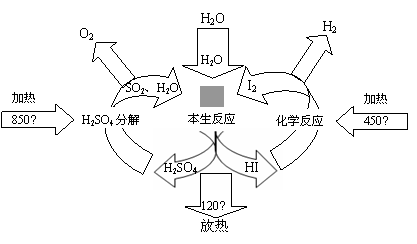 氢能是一种绿色能源,一种目前成熟的方法是利用碘硫热化学循环制备氢气,其原理示意图如下。
氢能是一种绿色能源,一种目前成熟的方法是利用碘硫热化学循环制备氢气,其原理示意图如下。
(1)已知:SO3(g)  SO2(g)+1/2O2(g) △H1 =-98.3kJ·mol-1
SO2(g)+1/2O2(g) △H1 =-98.3kJ·mol-1
H2SO4(l)  SO3(g) + H2O(l) △H2 =-130.4 kJ·mol-1
SO3(g) + H2O(l) △H2 =-130.4 kJ·mol-1
2H2SO4(l)  2SO2(g)+ O2(g)+ 2H2O(l) △H3
2SO2(g)+ O2(g)+ 2H2O(l) △H3
则△H3= kJ·mol-1 。
(2)上述热化学循环制氢要消耗大量的能量,从能源角度考虑,可采用的解决方案是
。
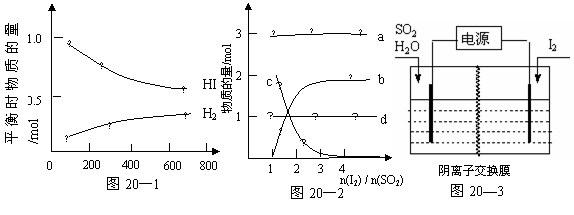
(3)碘化氢热分解反应为:2HI(g) H2(g) + I2(g),分解曲线如图20—1,分解反应平衡常数表达式为:K= ;升高温度时平衡常数K (选填:“增大”或“减小”)。
H2(g) + I2(g),分解曲线如图20—1,分解反应平衡常数表达式为:K= ;升高温度时平衡常数K (选填:“增大”或“减小”)。
(4)本生(Bunsen)反应中SO2和I2及H2O发生的反应为:SO2+I2+2H2O=3H++HSO4-+2I-,
I-+I2 I3-。
I3-。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如图20—2,图中b变化表示的离子是 ;在水相中进行的本生反应必须使水和碘显著过量,但易
引起副反应将反应器堵塞等。写出浓硫酸与HI发生反应生成硫和碘的化学方程式
。
②野村(Nonura)等人提出利用电解的方法进行本生反应,反应原理如图20—3所示,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105 Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)
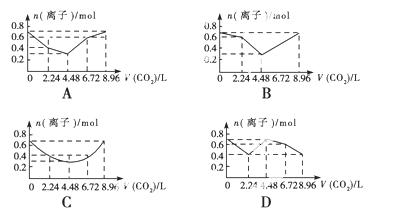
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com