
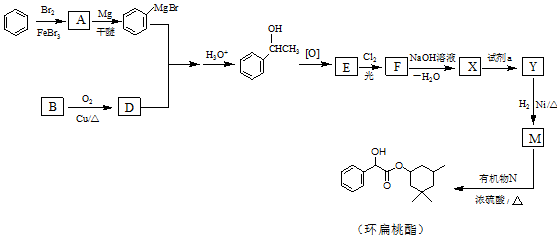
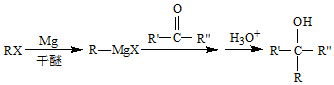 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)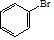 .
.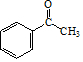 .
.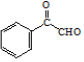 .
. .
.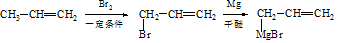
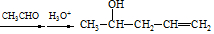
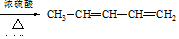 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件). 分析 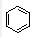 与Br2在FeBr3作催化剂的条件下发生取代反应,故A的结构简式为
与Br2在FeBr3作催化剂的条件下发生取代反应,故A的结构简式为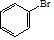 ,B应该是醇在Cu作催化剂的条件下催化氧化生成D(醛),结合题目给的已知条件,以及产物
,B应该是醇在Cu作催化剂的条件下催化氧化生成D(醛),结合题目给的已知条件,以及产物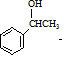 ,得到D的结构简式为CH3CHO,故B的结构简式为CH3CH2OH,
,得到D的结构简式为CH3CHO,故B的结构简式为CH3CH2OH, 2-羟基醇氧化生成酮,则E的结构简式为
2-羟基醇氧化生成酮,则E的结构简式为 ,
, 和Cl2在光照的条件下发生取代反应,且F的分子式为C8H6Cl2O,故F的结构简式为
和Cl2在光照的条件下发生取代反应,且F的分子式为C8H6Cl2O,故F的结构简式为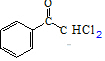 ,F和NaOH水溶液发生取代反应,得到的产物中一个碳原子上有两个羟基不稳定,脱水生成醛,则X的结构简式
,F和NaOH水溶液发生取代反应,得到的产物中一个碳原子上有两个羟基不稳定,脱水生成醛,则X的结构简式 ,Y和H2发生加成反应生成M,结合环扁桃酯的结构简式,则Y的结构简式为
,Y和H2发生加成反应生成M,结合环扁桃酯的结构简式,则Y的结构简式为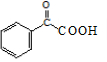 ,M的结构简式为
,M的结构简式为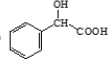 据此进行(1)~(6)分析,
据此进行(1)~(6)分析,
(7)由CH3CH=CH2、CH3CHO为有机原料,合成CH2=CHCH=CHCH3,可以用CH3CH=CH2和Br2在光照的条件下发生取代反应生成BrCH2CH=CH2,再与镁、乙醚作用生成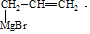 ,再与CH3CHO及H3O+,作用生成
,再与CH3CHO及H3O+,作用生成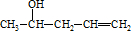 ,最后在浓硫酸的作用下发生脱水反应得到目标产物.
,最后在浓硫酸的作用下发生脱水反应得到目标产物.
解答 解: 与Br2在FeBr3作催化剂的条件下发生取代反应,故A的结构简式为
与Br2在FeBr3作催化剂的条件下发生取代反应,故A的结构简式为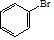 ,B应该是醇在Cu作催化剂的条件下催化氧化生成D(醛),结合题目给的已知条件,以及产物
,B应该是醇在Cu作催化剂的条件下催化氧化生成D(醛),结合题目给的已知条件,以及产物 ,得到D的结构简式为CH3CHO,故B的结构简式为CH3CH2OH,
,得到D的结构简式为CH3CHO,故B的结构简式为CH3CH2OH, 2-羟基醇氧化生成酮,则E的结构简式为
2-羟基醇氧化生成酮,则E的结构简式为 ,
, 和Cl2在光照的条件下发生取代反应,且F的分子式为C8H6Cl2O,故F的结构简式为
和Cl2在光照的条件下发生取代反应,且F的分子式为C8H6Cl2O,故F的结构简式为 ,F和NaOH水溶液发生取代反应,得到的产物中一个碳原子上有两个羟基不稳定,脱水生成醛,则X的结构简式
,F和NaOH水溶液发生取代反应,得到的产物中一个碳原子上有两个羟基不稳定,脱水生成醛,则X的结构简式 ,Y和H2发生加成反应生成M,结合环扁桃酯的结构简式,则Y的结构简式为
,Y和H2发生加成反应生成M,结合环扁桃酯的结构简式,则Y的结构简式为 ,M的结构简式为
,M的结构简式为 ,
,
(1)由以上分析可知,A的结构简式是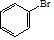 ,
,
故答案为: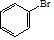 ;
;
(2)B的结构简式为CH3CH2OH,D的结构简式为CH3CHO,故B→D的化学方程式是2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;
(3)①由以上分析可知,E的结构简式是 ,
,
故答案为: ;
;
②由以上分析可知,E→F的反应类型是取代反应,
故答案为:取代反应;
(4)由以上分析可知,X的结构简式是 ,
,
故答案为: ;
;
(5)X的结构简式为 ,在试剂a的作用下生成Y,
,在试剂a的作用下生成Y, ,故X→Y发生氧化反应,则试剂a为O2,
,故X→Y发生氧化反应,则试剂a为O2,
故答案为:O2;
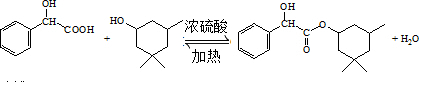
(6)生成环扁桃酯的化学方程式是 ,
,
故答案为: ;
;
(7)由CH3CH=CH2、CH3CHO为有机原料,合成CH2=CHCH=CHCH3,可以用CH3CH=CH2和Br2在光照的条件下发生取代反应生成BrCH2CH=CH2,再与镁、乙醚作用生成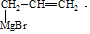 ,再与CH3CHO及H3O+,作用生成
,再与CH3CHO及H3O+,作用生成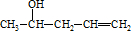 ,最后在浓硫酸的作用下发生脱水反应得到目标产物,故故合成路线为
,最后在浓硫酸的作用下发生脱水反应得到目标产物,故故合成路线为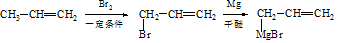
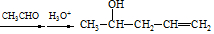
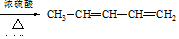 ,
,
故答案为: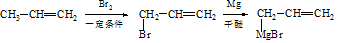
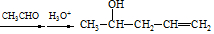
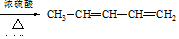 .
.
点评 本题考查有机物的推断与合成、有机方程式的书写,为高考常见题型,需要对给予的信息进行利用,较全面地考查学生的有机化学基础知识和逻辑思维能力,也有利于培养学生的自学能力和知识的迁移能力,题目难度中等


科目:高中化学 来源: 题型:解答题
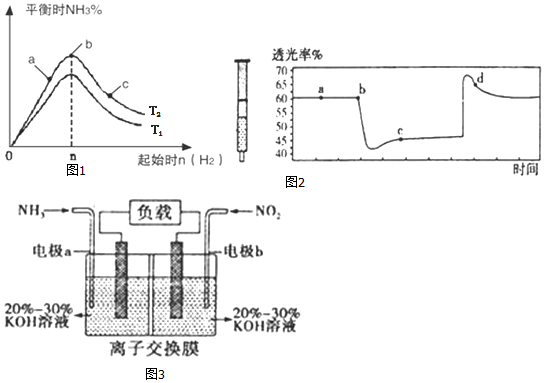
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑩ | B. | ①③⑥⑧ | C. | ①④⑧⑨ | D. | ②⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;A、C、D形成的化合物
;A、C、D形成的化合物 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,可以形成多种化合物.回答以下问题:
氮是重要的非金属元素,可以形成多种化合物.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等. Mg2FeH6+Mg.
Mg2FeH6+Mg.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小 | |
| B. | 酸碱中和滴定时,若未用待测液润洗锥形瓶,对测定结果无影响 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤洗涤并收集沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com