
| A. | X的还原性大于Y | B. | X-的还原性大于Y- | ||
| C. | Y的氧化性小于X | D. | Y的氧化性大于X |
科目:高中化学 来源: 题型:解答题
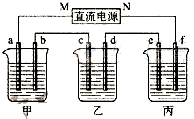 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放200g 10.00%的NaCl溶液、足量的CuSO4溶液和200g 10.00%的KNO3溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
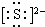 K+ PCl3
K+ PCl3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K的原子结构示意图 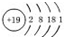 | B. | CO2的结构式 O-C-O | ||
| C. | C-12原子的表示方法:C612 | D. | NH4Cl的电子式: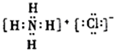 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若两者中有一种为强电解质,则一定是BOH | |
| B. | 若HA是强酸,混合液中离子浓度关系一定是C(A-)>C(B+)>C(HO-)>C(H+) | |
| C. | 若混合液中存在离子水解,则一定是A-水解 | |
| D. | 两者混合后,BOH有可能过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com