
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
(1)①碳; 铁; ②4OH--4e-===2H2O+O2↑;(2)①2Cl-+2H2O通电Cl2↑+H2↑+2OH-;
②2H2O+O2+4e-===4OH- 氧化反应;③13。
解析试题分析:由图可知 甲池是原电池,乙池是电解池; (1) ①对于甲池来说,Fe为负极,失去电子,Cu2+在碳棒上得到电子,变为单质Cu附着在上边。所以若两池中均为CuSO4溶液,反应一段时间后碳棒上会有红色的铜单质产生;对于乙池来说,C为阳极,Fe为阴极。所以Cu2+在铁棒上得到电子,变为单质Cu附着在上边。因此反应一段时间后铁棒上会有红色的铜单质产生;②在乙池中OH-的放电能力比SO42-强,所以是OH-在阳极放电。该电极反应式是4OH--4e-===2H2O+O2↑;(2)若两池中均为饱和NaCl溶液,①在乙池中阳离子的放电能力是H+>Na+,所以在阴极上H+放电;阴离子的放电能力是Cl- >OH-,所以是Cl-在阳极上放电。总反应的离子方程式是2Cl-+2H2O通电Cl2↑+H2↑+2OH-;②对于甲池中来说,碳极为正极,由于是中性环境,所以发生的是吸氧腐蚀,在C棒上电极反应式是2H2O+O2+4e-===4OH-;②乙池中碳极是阳极,所以在C棒上发生的反应是氧化反应,反应式是2Cl--2e-= Cl2↑;③若乙池转移0.02 mol e-后停止实验根据反应方程式可知产生OH-的物质的量为0.02 mol,由于V=0.2L,所以c(OH-)=0.1mol/L;根据水的离子积常数可得c(H+)=10-14÷10-1=10-13mol/L所以溶液混匀后的pH=13。
考点:考查原电池、电解池的反应原理及应用的知识。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:单选题
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
⑵写出在电解过程中阳极发生的电极方程式: 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。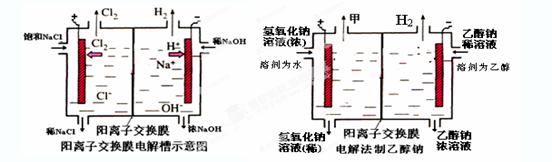
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。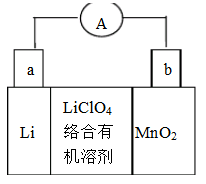
回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为____。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是____________。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
⑴A为 (填“原电池”或“电解池”),其中Ag电极的电极反应式为: ;发生 反应(填“氧化”或“还原”)。
⑵B装置中的电极b极为 极,电极反应式为 ,
总反应的化学方程式为 。
⑶工作一段时间后,当Zn片质量减少6.5g时,a极逸出的气体在标准状况下的体积 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。[来源:学科网ZXXK]
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
(1)“热敷袋”放出的热量是利用铁发生了 反应放出热量。
(2)炭粉的主要作用是 。
(3)加入氯化钠的主要作用是 。
(4)木屑的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com