
在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/L CH3COOH溶液中逐滴加入0.01mol/L NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH—V(NaOH)图像,如图所示。请分析:
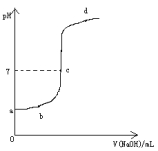
(1)在滴加NaOH溶液至过量过程中的溶液中溶质的变化情况,a、b、c、d各点的溶质各是什么?
(2)CH3COOH与NaOH恰好完全反应的点在图像中的位置在 区域内。(填:pH>7或pH<7或 pH=7),由此可验证CH3COOH为 (填:弱酸或强酸)此时共滴加V(NaOH)= mL。
(3)若将此实验改为中和滴定实验应用 作为指示剂。
(4)随着NaOH的加入,水的电离受到一定的影响,当水的电离达到最大时溶液中的溶质为 。
(5)当测得pH为7时共用去V(NaOH)=VmL,请用V的表达式表示此时CH3COOH的电离平衡常数。
科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:计算题
有机物A是烃的含氧衍生物,在同温同压下,A蒸气与乙醇蒸气的相对密度是2。1.38g A完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g;通过计算确定A的分子式(写出必要的文字说明、计算过程)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上月考二化学卷(解析版) 题型:选择题
相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1
②它们所含的原子总数目之比为3∶4
③它们所含的O原子数目之比为1∶2
④它们所含的H原子数目之比为1∶1
⑤它们所含的质子数目之比为5∶9
A.①②③ B.③④⑤ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是

A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一12月月考化学试卷(解析版) 题型:选择题
把铁片分别放入下列物质的溶液中,充分反应后,溶液质量比反应前减轻的是
A.CuSO4 B.Fe2(SO4)3 C.HCl D.FeSO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:选择题
常温下,向10mL 0.1mol·L﹣1 NaOH溶液中逐滴加入0.1mol·L﹣1的CH3COOH溶液,其pH 逐渐减小,图中a、b、c三点的pH为实验中所测得。下列有关说法中一定正确的是
逐渐减小,图中a、b、c三点的pH为实验中所测得。下列有关说法中一定正确的是
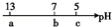
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO﹣)>c(Na+)
D.继续滴加0.1 mol·L﹣1的CH3COOH溶液,溶液的pH最终可以变化至1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二12月月考化学试卷(解析版) 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是
A.3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:
c(Na+)>c(CO32—)>c(HCO3—)>c(OH-)>c(H+)[
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:
c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-)
C.常温下,pH=6的NaHSO3溶液中:c(SO32—)-c(H2SO3)=9.9×10-7 mol·L-1
D.物质的量浓度之比为1∶2的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=2c(HCO3—)+2c(H2CO3)+2c(CO32—)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上期中化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.直径介于1nm~100nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二12月月考化学卷(解析版) 题型:选择题
反应2NO2(g) N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是
N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是
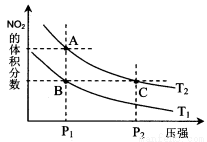
A.T2 > T1,P2 > P1
B.B、C两点的反应速率:B > C
C.A点的气体颜色比B点的深
D.A、C两点气体的平均相对分子质量:A < C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com