
【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .
【答案】
(1)Ne;F、O;Na;Si
(2)HClO4;Al(OH)3;NaOH;![]()
(3)Na
(4)PH3
(5)2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
(6)缓慢;Be+2HCl═BeCl2+H2↑
【解析】解:由元素在周期表中的位置可知,①为H,②为Na,③为Al,④为C,⑤为Si,⑥为P,⑦为O,⑧为F,⑨为Cl,⑩为Ne.
(1.)稀有气体Ne化学性质最不活泼;氧元素、氟元素没有正化合价;同周期自左而右金属性减弱,同主族自上而下金属性增强,Na的金属性最强,单质的还原性最强;可用于制半导体材料的元素是硅,所以答案是:Ne;F、O;Na;Si;
(2.)F元素没有最高价含氧酸,最高价氧化物的水化物酸性最强的是HClO4 , Al(OH)3是两性氢氧化物,上述元素中Na的金属性最强,故最高价氧化物的水化物碱性最强的是NaOH,电子式为 ![]() 所以答案是:HClO4;Al(OH)3;NaOH;
所以答案是:HClO4;Al(OH)3;NaOH; ![]() ;
;
(3.)同周期自左而右原子半径减小,一般电子层越多原子半径越大,原子半径最大的是Na,所以答案是:Na;
(4.)O、Cl、P中P的非金属性最弱,非金属性越强,对应氢化物越稳定,故PH3 稳定性最弱,所以答案是:PH3;
(5.)②元素最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,所以答案是:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑;
(6.)Be的金属性比Li的弱,单质铍与酸反应比单质锂与酸反应更加缓慢,Be与盐酸发生置换反应生成BeCl2与H2 , 反应方程式为:Be+2HCl═BeCl2+H2↑,所以答案是:缓慢;Be+2HCl═BeCl2+H2↑.


科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置. 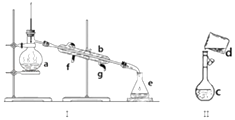
(1)写出下列仪器的名称:a.b.c. .
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 , 将仪器补充完整后进行实验,温度计水银球的位置在处.冷凝水由(填f或g)口通入.
(3)现需配制0.1mol/L CuSO4溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是 . 除图中给出的仪器和分析天平外,为完成实验还需的仪器有: .
②根据计算得知,需称取的胆矾的质量为g.
③在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g.若反应后溶液的体积不变,所得溶液中FeSO4的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 10g46%的乙醇水溶液中所含氢原子数目为1.2NA
B. 1L1mol/L Na2CO3溶液中含有NA个CO32-
C. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D. 常温下pH=1的H2SO4溶液中,H+的浓度为0.20mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是 ( )

A. t1时刻前,A1片的电极反应为:2A1+3H2O - 6e- ═ A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH- ═ 2NO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是应用电化学方法检测空气中SO2的原理示意图。下列有关说法不正确的是

A. 该装置工作时能将化学能转变为电能,并有H2SO4生成
B. 电极b表面O2发生还原反应,电极附近溶液的pH升高
C. 电极a表面的电极反应式为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
D. 气体样品应从电极a区域通入,样品中的SO2在电极a表面得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S ![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为 .
(2)写出上述反应生成物中,属于非电解质的物质的电子式 , 属于电解质的物质的电子式 .
(3)上述反应中,每生成1mol氧化产物,消耗KNO3的质量为(保留1位小数).
(4)黑火药爆炸后气体产物中有一种能造成酸雨的物质,它与酸性高锰酸钾溶液反应,能使溶液生成Mn2+而使紫红色退去.
①气体产物与酸性高锰酸钾溶液反应的离子方程式 .
②利用如图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com