
 通过膜电池可除去废水中的乙酸钠和对氯笨酚(
通过膜电池可除去废水中的乙酸钠和对氯笨酚( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | B为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为 +e-═Cl-+ +e-═Cl-+ | |
| D. | 当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,以此解答该题.
-OH+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极.
-OH+Cl-,电流从正极经导线流向负极.
A.A为正极,发生还原反应,故A错误;
B.电流从正极A沿导线流向负极B,故B错误;
C.A为正极,正极有氢离子参与反应,电极反应式为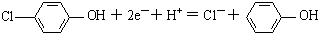 ,故C错误;
,故C错误;
D.据电荷守恒,当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA,故D正确;
故选D.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2mol SO 2、1mol O 2 | 4mol SO 3 |
| n (SO 3)/mol | 1.6 | a |
| 反应物的转化率 | α 1 | α 2 |
| A. | α 1+α 2>1 | |
| B. | 1.6<a<3.2 | |
| C. | 若甲中反应2 min时达到平衡,则2 min 内平均速率 ν (O 2)=“0.2“molL -1min -1 | |
| D. | 甲平衡后再加入0.2 mol SO 2、0.2 mol O 2和0.4 mol SO 3,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Na+浓度增大,有O2放出 | B. | 溶液中OH-总数不变,有O2放出 | ||
| C. | 溶液的pH增大,有O2放出 | D. | 溶液中Na+总数减少,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中ClO-的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A. | 该反应的还原剂是Cl- | |
| B. | 反应后溶液的酸性明显增强 | |
| C. | 消耗1mol还原剂,转移6 mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用玻璃棒蘸取次氯酸钠溶液,点在pH试纸上 | 试纸最终显蓝色 | 次氯酸钠溶液显碱性 |
| B | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH溶液中至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 白色沉淀变为蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数与转化关系: | |
| B. | 向烧碱液中通入SO2后的产物: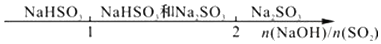 | |
| C. | 铁和稀硝酸反应: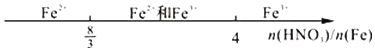 | |
| D. | 向AlCl3 溶液中滴加 NaOH 溶液,铝元素的存在形式: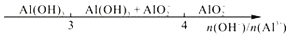 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
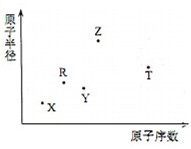 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T.下列推断错误的是( )| A. | 形成的简单离子半径的大小顺序为T>Y>Z | |
| B. | Z2Y、Z2Y2所含有的化学键类型相同 | |
| C. | 0.005mol•L-1T的最高价氧化物对应水化物的水溶液pH等于2 | |
| D. | Z2T的水溶液显碱性,对水的电离有促进作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.
紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取.| 乙醇 | 四氯化碳 | 碘(晶体) | |
| 密度/g•cm-3 | 0.7893 | 1.595 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 184.35 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com