
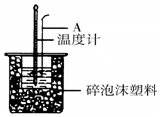
 50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ�
50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ����� ��1���к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�����
��2������װ��ͼ�������кͷ�Ӧ�Ƿ��ȷ�Ӧ���¶ȼ��ϵ�����NaOH��Һ��Ӧ���ȣ�ʹ�¶ȼƶ������ߣ��¶Ȳ�ƫС��
��3���к�����ǿ���ǿ���ϡ��Һ��ȫ��Ӧ����1molˮ�ų�����������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ�д���Ȼ�ѧ����ʽ��
��4������������ʵ������ȷ�����
��5�������к��ȵļ��㹫ʽ��H=-$\frac{cm��T}{n}$��ȷ��ʵ������Ҫ�����ݣ�
��� �⣺��1���к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�������С�ձ�֮��������ֽ���������Ǽ���ʵ������е�������ʧ��
�ʴ�Ϊ������ʵ������е�������ʧ��
��2����װ��ͼ��֪������A�������ǻ��β�����������кͷ�Ӧ�Ƿ��ȷ�Ӧ���¶ȼ��ϵ�����NaOH��Һ��Ӧ���ȣ�ʹ�¶ȼƶ������ߣ��¶Ȳ�ƫС������ƫС������õ��к���ƫ����H��-57.3KJ/mol��
�ʴ�Ϊ�����β��������������
��3��ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�57.3kJ��������ϡ�����ϡ����������Һ����ǿ���ǿ���ϡ��Һ����Ӧ���Ȼ�ѧ����ʽΪ��HNO3��aq��+KOH��aq��=KNO3��aq��+H2O��l����H=-57.3KJ/mol��
�ʴ�Ϊ��HNO3��aq��+KOH��aq��=KNO3��aq��+H2O��l����H=-57.3KJ/mol��
��4��һˮ�ϰ�Ϊ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������С��57.3kJ��
�ʴ�Ϊ��ƫС��
��5���ɷ�Ӧ�ȵļ��㹫ʽ��H=-$\frac{cm��T}{n}$��֪����Ӧ���к��ȼ���ʱ��������Ҫ�������У�������c�����Ũ�Ⱥ���������Ũ�Ⱥ��������Ӧǰ���¶ȱ仯��T��Ȼ��������Ӧ����Һ������������ˮ�����ʵ�����
��ѡ��C��
���� ���⿼��ѧ���й��к��ȵIJⶨ����Ŀ�Ѷ��еȣ�ע�������к��ȵĸ���Ͳⶨԭ���ǽ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
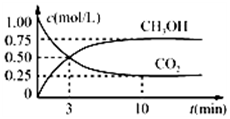 �����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�������CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ���ǣ�������
�����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�������CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �û�ѧ��Ӧ��3 minʱ�ﵽƽ��״̬ | |
| B�� | ���������������䣬�����¶ȣ�ƽ��ʱc��CH3OH��=0.85 mol•L-1����÷�Ӧ���� | |
| C�� | ����ͬ�¶��£����������ݻ��ɱ䣬����������ѹǿ���䣬ͬ���������г���1 molCO2��3mol H2����ƽ��ʱCO2��Ũ����ͼ����ͬ | |
| D�� | 12 minʱ���������������ٳ���0.25 mol CO2��0.25 mol H2O��g������ʱ��Ӧ�����淴Ӧ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ӧ���ͼӾ۷�Ӧ
��Ӧ���ͼӾ۷�Ӧ ��Ӧ����ȡ����Ӧ
��Ӧ����ȡ����Ӧ ��Ӧ����ȡ����Ӧ
��Ӧ����ȡ����Ӧ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӻ��������Ŀ����״�Ͳ����ӻ���ԭ�ӹ����Ŀ����״����ͬ | |
| B�� | �����ӻ��������״��������ȣ� NH3��N�ǵ����ӻ� | |
| C�� | ���ӻ�����ڿռ�Ӧ������ӶԻ������ۣ���ʹ�ų�����С | |
| D�� | sp3�ӻ����Ӧ��ͬԭ����������ͬ��s��p����ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʹ��Һ��pH���� | |
| B�� | ����ʹ��Һ��c��H+��•c��CH3COO-����С | |
| C�� | ����ʹ��Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$��ֵ���� | |
| D�� | ��Һ��$\frac{c��{H}^{+}��•c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
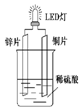 ��Zn��CuΪ�缫��ϡ����Ϊ�������Һ�γɵ�ԭ��أ���LED���⣬װ����ͼ��ʾ��
��Zn��CuΪ�缫��ϡ����Ϊ�������Һ�γɵ�ԭ��أ���LED���⣬װ����ͼ��ʾ��
| ��� | �� | �� | �� |
| װ�� |  | 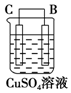 |  |
| ���� | ���۽���A�����ܽ� | C���������� | A����������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com