
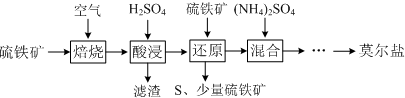
分析 由流程可知,①中溶解,②中加氯化钡除去SO42-,③中NaOH除去Mg2+,④中碳酸钠除去Ca2+,⑤中过滤,滤液中加盐酸后蒸发、结晶得到精盐.
(1)除杂试剂过量,可将杂质完全转化为沉淀;
(2)加盐酸排除干扰离子,再加氯化钡观察是否生成白色沉淀检验SO42-离子.
解答 解:(1)加过量BaCl2溶液的原因是使SO42- 完全沉淀被除去,故答案为:使SO42- 完全沉淀被除去;
(2)最简单的方法检验溶液中有无SO42-离子的方法为取溶液适量于试管中,滴加足量盐酸使溶液酸化,再滴加几滴BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-,若无白色沉淀生成,则说明溶液中不含SO42-,
故答案为:取溶液适量于试管中,滴加足量盐酸使溶液酸化,再滴加几滴BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-,若无白色沉淀生成,则说明溶液中不含SO42-.
点评 本题考查混合物分离提纯,为高频考点,把握元素化合物知识、除杂的原则及试剂加入顺序为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
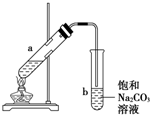
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的盐溶液一定显酸性 | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | X、W分别形成的简单气态氢化物可反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
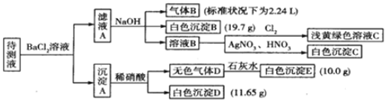
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com