
在 2 L的密闭容器中, 充入 1 mol N2和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 计算:(1) 平衡时混合气体中三种气体的物质的量比为多少?
(2) N2的转化率为多少?
(3) 2分钟内, NH3的平均反应速率为多少?
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2015届贵州省高一第二学期期末检测化学试卷(解析版) 题型:选择题
将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是(
)
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是(
)
A. 用物质B表示2s内的平均反应速率为0.6 mol/(L·s)
B. 用物质A表示2 s内的平均反应速率为0.3 mol/(L·s)
C. 2 s后物质A的转化率为70%
D. 2 s后物质B的浓度为0.35 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高一下学期期中考试化学试卷(解析版) 题型:填空题
(一)、将2 mol SO2和1 mol
O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 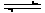 2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
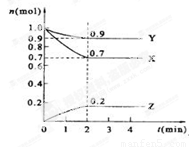
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应达到平衡。
查看答案和解析>>
科目:高中化学 来源:2014届河北省高二10月月考化学试卷(解析版) 题型:填空题
(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”).
(2)能判断该反应是否已达化学平衡状态的依据是________.
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO平衡浓度为0.25 mol/L,试判断此时的温度为________℃.
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________.
a.等于1.0 mol b.大于1.0 mol
c.大于0.5 mol d.无法确定
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二下学期期中考试化学试卷(解析版) 题型:填空题
(10分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市朝阳区高三第一学期期末考试化学试卷 题型:填空题
已知工业制氢气的反应为CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2
L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2
L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
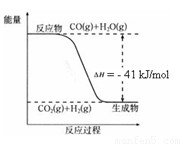
(1)增加H2O(g)的浓度,CO的转化率将 (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K = 。400 ℃时的平衡常数K 9(填“>”“<”或”“=”)。
(3)500 ℃时,10 min内v(H2O)= ,在此过程中体系的能量将 (填“增加”或“减少”) kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com