
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C. 2p和3p轨道形状均为哑铃形,能量也相等
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
【答案】B
【解析】A.根据“洪特规则”可知,2p轨道电子的自旋方向应该相同,正确的电子排布图为:![]() ,A错误;B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,B正确;C.2p和3p轨道形状均为哑铃形,但是原子轨道离原子核越远,能量越高,2p轨道能量低于3p,C错误;D.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,D错误;答案选B;
,A错误;B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,B正确;C.2p和3p轨道形状均为哑铃形,但是原子轨道离原子核越远,能量越高,2p轨道能量低于3p,C错误;D.基态Na的电子排布式为1s22s22p63s1,由基态转化成激发态1s22s22p63p1时,电子能量增大,需要吸收能量,D错误;答案选B;
点睛;本题考查原子核外电子的排布、原子核外电子的跃迁,注意掌握样子核外电子的跃迁过程中能量变化,核外电子排布规律及电子排布与元素位置的关系,注意洪特规则的应用。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是( )
A. 过滤操作中,漏斗的尖端应接触烧杯内壁
B. 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
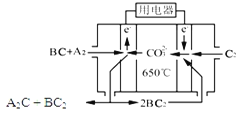
【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测得某溶液中仅含Cu2+、K+、SO42-、Cl-四种离子,且阳离子的数量比为Cu2+:K+=3:4,则SO42-:Cl-的比值可能是
A. 3:2 B. 2:1 C. 1:8 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
A. 2-甲基-2-丁烯 B. 3-甲基-1-丁炔
C. 2-甲基-2-丁炔 D. 2-甲基-1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法中,不正确的是( )
A. Fe2O3可以做油漆的颜料
B. 王水可以雕刻玻璃
C. Al2O3可用作耐火材料
D. 赤铁矿可用作炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为_____________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_______(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是__________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。

①a属于__________(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________________________________ (标出配位键)。
③c中Be原子的杂化方式为__________。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B. σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如下图所示。

若BeO晶体的密度为dg/cm3,则晶胞参数a =______nm (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
A. 平衡向正方向移动 B. 平衡不发生移动
C. C的体积分数减小 D. C的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
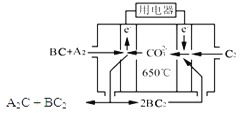
【题目】短周期主族元素A、B、C、D、E原子序数依次增大 ,A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______。W的电子式_________。
(2)在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5 mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
① 计算该温度下此反应的平衡常数K =_________________。
②三个容器中的反应分别达平衡时下列各组数据关系正确的是___________(填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
(3)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com