
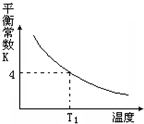
 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
分析 A.根据v=$\frac{△c}{△t}$计算v(X),再根据速率之比等于化学计量数之比计算v(Z);
B.由图可知,随温度升高,平衡常数减小,说明升高温度平衡向逆反应方向移动;由表中数据可知,5min到达平衡,利用三段式表示出平衡时各组分的物质的量,由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,再与温度T1时的平衡常数比较判断温度高低;
C.设参加反应的X为amol,利用三段式表示出平衡时各组分的物质的量,由于反应前后气体的体积不变,用物质的量代替浓度代入平衡常数表达式列方程计算;
D.由B中数据可知,平衡时参加反应的X为1mol-0.5mol=0.5mol,则X的转化率为$\frac{0.5mol}{1mol}$×100%=50%.由于反应前后气体体积不变,故X、Y的起始物质的量满足1:2时为等效平衡,平衡时X的转化率相等,在T℃时,以1molX、2molY和1molZ充入上述容器中,所到达的平衡等效为开始通入2molX、4molY到达的平衡,再通入1molZ,结合平衡移动判断.
解答 解:A.由表中数据可知,前5min内参加反应的X为1mol-0.5mol=0.5mol,则v(X)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05 mol/(L•min),速率之比等于化学计量数之比,v(Z)=2v(x)=0.1 mol/(L•min),故A错误;
B.由图可知,随温度升高,平衡常数减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,
由表中数据可知,5min到达平衡,平衡时X为0.5mol,则:
X(g)+Y(g)?2Z(g)
开始(mol):1 2 0
转化(mol):0.5 0.5 1
平衡(mol):0.5 1.5 1
由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,故K=$\frac{{1}^{2}}{0.5×1.5}$=$\frac{4}{3}$,小于温度T1时的平衡常数4,故温度T1>T,故B错误;
C.设参加反应的X为amol,则:
X(g)+Y(g)?2Z(g)
开始(mol):1 2 0
转化(mol):a a 2a
平衡(mol):1-a 2-a 2a
则$\frac{(2a)^{2}}{(1-a)×(2-a)}$=4,解得a=$\frac{2}{3}$,则X的转化率为$\frac{\frac{2}{3}mol}{1mol}$×100%≈66.7%,故C正确;
D.由B中数据可知,平衡时参加反应的X为1mol-0.5mol=0.5mol,则X的转化率为$\frac{0.5mol}{1mol}$×100%=50%.由于反应前后气体体积不变,故X、Y的起始物质的量满足1:2时为等效平衡,平衡时X的转化率相等,在T℃时,以1molX、2molY和1molZ充入上述容器中,所到达的平衡等效为开始通入2molX、4molY到达的平衡基础上(此时平衡时X的转化率为50%),再通入1molZ,平衡向逆反应方向移动,X的转化率降低,故在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率小于为50%,故D错误,
故选C.
点评 本题考查化学反应速率计算、化学平衡常数计算及影响因素、化学平衡计算、等效平衡等,D中关键是对等效平衡的理解,也可以利用平衡常数计算判断,但比较繁琐,难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
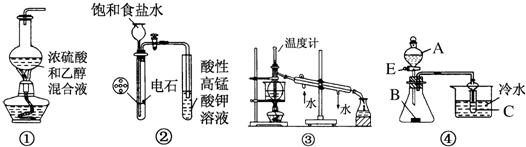
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
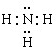 ,B的结构式为
,B的结构式为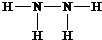 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
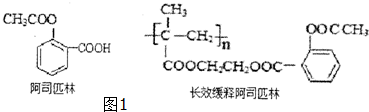
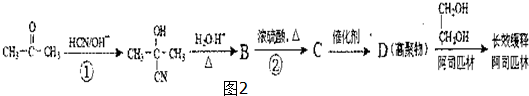
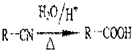 ,回答问题:
,回答问题: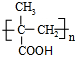 .
.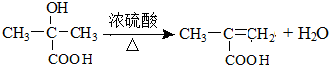 .
.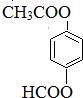 (只写一种).
(只写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
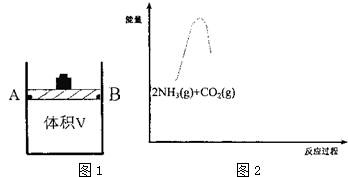
| CO2转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 30% | 65% | 75% | 75% |
| T | 45% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
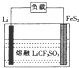 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com