
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 .
②Y电极上的电极反应式为 ,
③该反应的总反应方程式是: ﹣
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 .
②Y电极的材料是 ,电极反应式是 .
(3)若a为CuSO4溶液,则电解时的化学反应方程式为 、 通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的C(H+)= (假设电解后溶液体积不变).
(1) ①2H++2e﹣=H2↑;
②2Cl﹣﹣2e﹣=Cl2↑;
③2Cl﹣+2H2O═2H2+Cl2↑+2OH﹣;
(2)①纯铜;Cu2++2e﹣=Cu;
②粗铜;Cu﹣2e﹣=Cu2+;
(3)2CuSO4+2H2O  2Cu+O2↑+2H2SO4、2H2O
2Cu+O2↑+2H2SO4、2H2O  O2↑+2H2↑;0.8mol;
O2↑+2H2↑;0.8mol;
(4)0.1mol/L.
【解析】
试题分析:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl﹣﹣2e﹣=Cl2↑,③阳极上是氯离子离子失电子,阴极上是氢离子得电子,电解总反应离子方程式为:2Cl﹣+2H2O═2H2+Cl2↑+2OH﹣。
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为
Cu2++2e﹣=Cu,②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu﹣2e﹣=Cu2+,
(3)若a为CuSO4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电,Y电极上氢氧根离子放电,所以电池反应式有
2CuSO4+2H2O  2Cu+O2↑+2H2SO4、2H2O
2Cu+O2↑+2H2SO4、2H2O  O2↑+2H2↑;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,所以阴极上析出氢气、Cu,根据原子守恒得n(H2)=n(H2O)=0.2mol,n(CuO)=n(Cu)=0.2mol,
O2↑+2H2↑;通过一段时间后,向所得溶液中加入0.2molCu(OH)2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH2O,所以阴极上析出氢气、Cu,根据原子守恒得n(H2)=n(H2O)=0.2mol,n(CuO)=n(Cu)=0.2mol,
设生成0.2molCu转移电子的物质的量为x、生成0.2mol氢气转移电子的物质的量为y,
2CuSO4+2H2O  2Cu+O2↑+2H2SO4转移电子
2Cu+O2↑+2H2SO4转移电子
2mol 4mol
0.2mol x
2mol:4mol=0.2mol:x
x=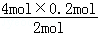 =0.4mol
=0.4mol
2H2O  O2↑+2H2↑ 转移电子
O2↑+2H2↑ 转移电子
2mol 4mol
0.2mol y
2mol:4mol=0.2mol:y
y=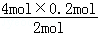 =0.4mol,
=0.4mol,
所以转移电子的物质的量=xmol+ymol=0.4mol+0.4mol=0.8mol;
(4)若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,
则生成n(Cl2)=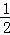 n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=
n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=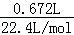 =0.03mol>0.02mol,
=0.03mol>0.02mol,
在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl2)+4n(O2)=0.04mol+0.04mol=0.08mol,
阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,
所以阴极上氢离子不放电,当阳极上生成氧气时,同时阳极附近有氢离子生成,电池反应式为2Cu2++2H2O  2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
根据氧气和氢离子的关系式得n(H+)=4n(O2)=0.04mol,
则C(H+)=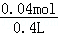 =0.1mol/L,
=0.1mol/L,
考点:原电池和电解池的工作原理..


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2014-2015学年河南省高一11月阶段性测试化学试卷(解析版) 题型:选择题
下列名词中,不属于物理量的是( )。
A.物质的量 B.质量 C.摩尔 D.长度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高二10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.放热反应发生时不必加热,吸热反应在加热后才能发生
B.反应热指的是反应过程中放出的热量
C.反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同
D.依据盖斯定律,热化学方程式具有加合性,也可以进行加、减、乘、除四则运算
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高一10月月考化学试卷(解析版) 题型:选择题
下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4 C.54 g Al D.1g CaCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高一10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B. 3.01×1023个SO2分子的质量为32g
C.CH4的摩尔质量为16g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市上学期10月月考高二化学试卷(解析版) 题型:选择题
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O;有关该电池的说法正确的是( )
Cd+2NiO(OH)+2H2O;有关该电池的说法正确的是( )
A. 放电时正极反应:NiO(OH)+e﹣+H2O═Ni(OH)2+OH﹣
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市上学期10月月考高二化学试卷(解析版) 题型:选择题
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl﹣﹣e﹣=AgCl
B. 每生成1mol Na2Mn5O10转移2mol电子
C. Na+不断向“水”电池的负极移动
D. AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高二上第一次月考化学(解析版) 题型:选择题
在地壳内,深度每增加1km,压强大约增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响。如:CaAl2Si2O8+Mg2SiO4=CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2.70 3.22 3.50
在地壳区域变质的高压条件下,有利于
A.钙长石生成 B.镁橄榄石生成
C.钙长石和镁橄榄石共存 D.(钙镁)石榴子石生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:填空题
(8分)在下列反应中:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.2H2O=2H2↑+O2↑
(1)水只作氧化剂的是(填序号,下同) ,
(2)水只作还原剂的是 ,
(3)水既作氧化剂又作还原剂的是 ,
(4)水既不作氧化剂又不作还原剂的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com