
【题目】据《朝闻天下》报道,河南驻马店发现特大天然碱,铅锌矿产资源。
试回答下列问题:
(1)在元素周期表中,铅与锗同主族,铅的周期数比锗大2。基态铅原子的价层电子排布式____,有_____个未成对电子。
(2)镓与锌同周期,原子序数比锌大1,锌的第一电离能大于镓的第一电离能。其原因是_____。
(3)天然碱的化学式Na2CO3·NaHCO3·2H2O。CO32-的立体构型是________;H2O中O原子采取______杂化。
(4)金是贵重金属。冶企工业上,提取企的原理是2[Au(CN)2]+ Zn=2Au+[Zn(CN)4]2-。
①与CN-互为等电子体的离子有______(任写一种); HCN分子中σ键与π键数目之比为______。
②[Zn(CN)4]2-的配体是________。
【答案】 6s26p2 2 基态锌原子的价层电子达到全充满的稳定结构 平面三角形 sp3 ![]() (或
(或![]() ) 1:1 CN-
) 1:1 CN-
【解析】(1)铅为82号元素,基态原子电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2,基态铅原子的价层电子排布式6s26p2,有2个未成对电子;(2)基态锌原子的价层电子达到全充满的稳定结构,故锌的第一电离能大于镓的第一电离能;(3)CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=![]() (a-xb)=
(a-xb)=![]() (4+2-2×3)=0,所以CO32-的空间构型是平面三角形;根据价层电子对互斥理论,四对电子相互排斥成四面体结构,可见四个轨道都参与了杂化,所以是sp3杂化;(4)①等电子体是指具有相同价电子数目和原子数目的分子或离子,与CN-互为等电子体的离子有
(4+2-2×3)=0,所以CO32-的空间构型是平面三角形;根据价层电子对互斥理论,四对电子相互排斥成四面体结构,可见四个轨道都参与了杂化,所以是sp3杂化;(4)①等电子体是指具有相同价电子数目和原子数目的分子或离子,与CN-互为等电子体的离子有![]() (或
(或![]() );HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为2:2=1:1;②[Zn(CN)4]2-的配体是CN-。
);HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为2:2=1:1;②[Zn(CN)4]2-的配体是CN-。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起。则对于气体A和液体B最可能的是 ( )
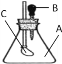
A. A是Cl2,B是饱和食盐水
B. A是CO2,B是NaHCO3饱和溶液
C. A是NO,B是水
D. A是SO2,B是烧碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
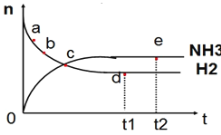
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有的氦合成气,液休燃料合成气制各工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备复合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是

A. O2和H2O均发生还原反应
B. 膜Ⅰ侧相当于原电池的正极
C. 膜Ⅱ侧发生的反应为: CH4+O2--2e-=2H2+CO
D. 膜Ⅱ侧消耗CH4与膜Ⅰ侧生成H的物质的量之比为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
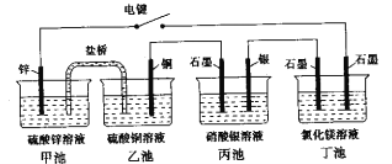
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中,正确的是( )
A. 苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B. 从苯的凯库勒式( )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C. 在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D. 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应与能量以及化学平衡原理是中学化学学习的重要内容。请回答下列问题:
⑴己知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是_________________________________。
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是_____________,A是______________。

⑶25 ℃时,向含a mol NH4Cl的水溶液滴加b L氨水后溶液呈中性,则所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5)
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H_______0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是_________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com