
在生产和生活中金属腐蚀难以避免。对图a和图b的分析合理的是

A.图a,负极上发生的反应是:O2+4e+2H2O → 4OH-
B.图b,接通开关后溶液中的H+向正极移动
C. 图a,插入海水中的铁棒,越靠近底端腐蚀越严重
D. 图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大
科目:高中化学 来源: 题型:
 (2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
(2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
| ||
| ||
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
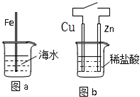 在生产和生活中金属腐蚀难以避免.对图a和图b的分析合理的是( )
在生产和生活中金属腐蚀难以避免.对图a和图b的分析合理的是( )| A、图a,负极上发生的反应是:O2+4e+2H2O→4OH- | B、图b,接通开关后溶液中的H+向正极移动 | C、图a,插入海水中的铁棒,越靠近底端腐蚀越严重 | D、图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
查看答案和解析>>
科目:高中化学 来源:上海市长宁区2013年高考一模化学试题 题型:013
|
在生产和生活中金属腐蚀难以避免.对图a和图b的分析合理的是
| |
| [ ] | |
A. |
图a,负极上发生的反应是∶O2+4e+2H2O→4OH- |
B. |
图b,接通开关后溶液中的H+向正极移动 |
C. |
图a,插入海水中的铁棒,越靠近底端腐蚀越严重 |
D. |
图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com