
【题目】CH3COOH中C原子轨道杂化类型为________________。
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A. 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F
B. 人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料
C. 短周期元素正化合价数值和其族序数相同
D. 短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如图所示装置进行实验,以探究苯与液溴发生反应的原理,并分离、提纯反应产物。
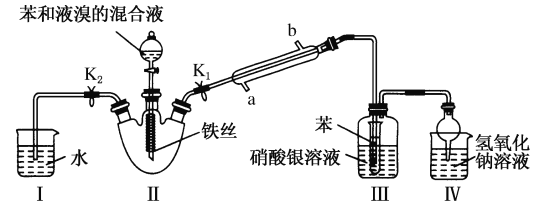
请回答下列问题:
(1)冷凝管所起的作用为________和________,冷凝水从________口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。装置Ⅲ中小试管内苯的作用是____________________________。
(3)能说明苯与液溴发生了取代反应的现象是_____________________。
(4)反应结束后,将装置I中的水倒吸入装置Ⅱ中。这样操作的目的是_______________________,
简述这一步骤的操作:_____________________________________。
(5)利用三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液 ②用5% NaOH溶液洗涤,振荡,分液 ③用蒸馏水洗涤,振荡,分液 ④加入无水CaCl2粉末干燥 ⑤________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现出不同的性质。下列现象不能说明上述观点的是( )
A.甲苯能使酸性KMnO4溶液褪色,甲基环己烷不能使酸性KMnO4溶液褪色
B.乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应
C.苯与浓硝酸反应生成硝基苯,而甲苯与浓硝酸反应生成三硝基甲苯
D.苯酚(![]() )可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
)可以与NaOH反应,而乙醇(CH3CH2OH)不能与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4,7二甲基香豆素(熔点:132.6 ℃)是一种重要的香料,广泛分布于植物界中,由间甲基苯酚为原料的合成反应如下:
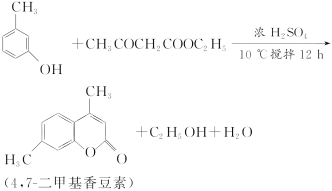
实验装置图如下:

主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0 ℃以下,搅拌下滴入间甲基苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持在10 ℃下,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的________________________。
(2)浓H2SO4需要冷却至0 ℃以下的原因是__________________________。
(3)反应需要搅拌12 h,其原因是_________________________________。
(4)本次实验产率为________。(百分数保留一位小数)
(5)实验室制备乙酸乙酯的化学反应方程式:_____________________________,用________(填药品名称)收集粗产品,用________(填操作名称)的方法把粗产品分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示反应A(g)+B(g)![]() nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )
nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是( )

A.反应起始由逆反应开始建立平衡
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.若其它条件相同,a比b的温度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
![]()
A.如图的键线式表示烃的名称为3甲基4乙基7甲基辛烷
B.符合分子式为C3H8O的醇有三种不同的结构
C.乙烯在一定条件下能发生加成反应、加聚反应,被酸性高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸
D.治疗疟疾的青蒿素的结构简式为 ,分子式是C15H20O5
,分子式是C15H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的主要反应之一。恒温条件下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。恒温条件下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com