
【题目】已知:
酸 | H2C2O4 | HF | H2CO3 | H2BO3 |
电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
①甲同学取一定体积的HF溶液,滴入2滴紫色石蕊试液,显红色,再加入NaF固体观察到的现象是_______________,则证明HF为弱酸。
②乙同学取10ml未知浓度的HF溶液,测其pH为a,然后用蒸馏水稀释至1000ml。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<_________(用含a的代数式表示)。
③丙同学用pH是指测得室温下0.10mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为__________________。
(2)①已知H2BO3与NaOH溶液反应的离子方程式为H2BO3+OH-=B(OH)4,写出硼酸的电离方程式______________。
②向等浓度的H2C2O4与H2BO3混合溶液中逐滴加入NaOH溶液,则与OH-作用的粒子(包括分子和离子)依次为_____________,____________,____________。
③NaH C2O4溶液中加入少量的Na2CO3溶液,反应的离子方程式___________。
【答案】
(1)①红色变浅;②a+2③1.0x10-3
(2)①H2BO3+H2O![]() B(OH)4-+H+;②H2C2O4,HC2O4-、H2BO3;
B(OH)4-+H+;②H2C2O4,HC2O4-、H2BO3;
(3)2HC2O4+CO32-=2C2O42-+H2O+CO2↑
【解析】
试题分析:(1)①HF在溶液中电离出氢离子和氟离子,溶液显酸性,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体,HF的电离平衡向逆方向移动,氢离子浓度减小,溶液的红色变浅,证明HF存在电离平衡,即HF为弱酸;故答案为:红色变浅;
②乙同学取10ml未知浓度的HF 溶液,测其pH 为a,然后用蒸馏水稀释至1000mL,体积增大102倍,弱酸加水稀释会存进弱酸的电离,稀释102倍,pH变化小于2个单位,所以稀释后pH=b<a+2;故答案为:a+2;
③用pH 试纸测得室温下0.10molL-1的HF 溶液的pH为2,则c(H+)=0.01mol/L,则Ka=![]() =
=![]() ≈1.0×10-3;故答案为:1.0×10-3;
≈1.0×10-3;故答案为:1.0×10-3;
(2)①由信息可知为一元酸,H3BO3电离除生成B(OH)4-外还生成H+,其方程式为:H3BO3+H2O![]() B(OH)4-+H+,故答案为:H3BO3+H2O
B(OH)4-+H+,故答案为:H3BO3+H2O![]() B(OH)4-+H+;
B(OH)4-+H+;
②由表中数据可知,H2C2O4的第一电离和第二步电离程度都大于H3BO3,所以NaOH先与H2C2O4、HC2O4-反应,然后与H3BO3反应;故答案为:H2C2O4、HC2O4-、H3BO3;
(3)草酸的第二电离常数大于碳酸的第一电离常数,所以NaHC2O4 溶液中加入少量的Na2CO3溶液,会生成二氧化碳,其化学方程式为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑;故答案为:2HC2O4-十CO32-=2C2O42-+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是
A. ①③ B. ③④ C. ①② D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示:
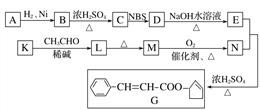
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1。
已知:CH3CH2CH===CH2![]() CH3CHBrCH===CH2
CH3CHBrCH===CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHOCH3CHOHCH2CHO
CH3CHOHCH2CHOCH3CHOHCH2CHO![]() CH3CH===CHCHO+H2O
CH3CH===CHCHO+H2O
请回答下列问题:
(1)A的结简式为__________,G中官能团的名称为___________。
(2)检验M已完全转化为N的实验操作是____________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______________。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L:________________,反应类型:________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)。________
请用以下方式表示:A![]() B…
B…![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.已知:
则可以计算出反应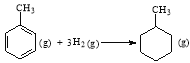 的ΔH为-384 kJ/mol
的ΔH为-384 kJ/mol
B.辛烷的标准燃烧热为-5518 kJ/mol。则辛烷燃烧的热化学方程式可表示为:
C8H18(g)+12.5O2(g)=== 8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol
C.2CO(g)+O2(g)===2CO2(g) ;ΔH=-566 kJ/mol
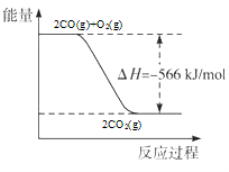
如图可表示该反应过程与能量的关系
D.S(s)+O2(g)===SO2(g);ΔH1
S(g)+O2(g)===SO2(g);ΔH 2 则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:
2NH3(g);△H = -92. 4 kJ/mol。现将1mol N2 (g)、3molH2 (g) 充入一容积为2 L的密闭容器中,在500℃下进行反应,第10min时达到平衡,NH3的体积分数为 ω,下列说法中正确的是:

A. 若达到平衡时,测得体系放出9. 24 kJ热量,则H2反应速率变化曲线如图a所示
B. 如图b所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92. 4kJ
C. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图c
D. 若起始加入物料为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g) = 2H2O(1) △H=―571.6kJ/mol![]()
B.2H2(g)+O2(g) = 2H2O(1) △H=+571.6 kJ/mol
C.H2(g)+![]() O2(g) = H2O(g) △H=―285.8 kJ/mol
O2(g) = H2O(g) △H=―285.8 kJ/mol
D.H2(g)+![]() O2(g) = H2O(1) △H=―285.8kJ/mol
O2(g) = H2O(1) △H=―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O、NaOH、Na2CO3可按某种标准划为同一类物质,下列分类标准正确的是
① 钠的化合物;② 能与硝酸反应的物质;③电解质;④细分为:碱性氧化物、碱、盐;
A. ①②③ B. ①②③④ C. ②③ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com