
分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$以及ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$结合分子、原子构成计算.
解答 解:相同条件下,体积之比为1:4的CH4和NH3两种气体,则物质的量之比为1:4,其分子数之比为1:4,原子数之比为1×5:4×4=5:16;氢原子的数目比为1×4:4×3=1:3;密度比等于质量之比,密度比为1×16:4×17=4:17;两种气体的质量之比为1×16:4×17=4:17,
故答案为:1:4;5:16;1:3;4:17;4:17.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 920kJ/mol | B. | 557kJ/mol | C. | 436kJ/mol | D. | 188kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 7.8 g Na2S和Na2O2中含有的阴离子数大于0.1NA | |
| C. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向含有H+,Al3+,Mg2+的溶液中,逐渐加入NaOH溶液 | |
| B. |  向Al2(SO4)3溶液中加入Ba(OH)2溶液 | |
| C. |  物质的量相等的镁和铝分别与等浓度、等体积的过量稀硫酸反应 | |
| D. |  向AlCl3溶液中加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
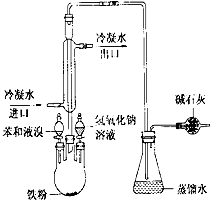 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com