
| A、0.044mol/L |
| B、0.44mol/L |
| C、4.4mol/L |
| D、44mol/L |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
| A、将铜屑加入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、氢氧化镁与稀硫酸反应:H++OH-=H2O |
| C、向小苏打溶液中加入醋酸溶液:HCO3-+H+=CO2↑+H2O |
| D、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n |
| B、有离子键的化合物一定是离子化合物 |
| C、某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
| D、元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、HCO3-、SiO32-、K+、H+ |
| C、Na+、Fe2+、NO3-、H+ |
| D、OH-、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、氢氧化铜加到盐酸中:OH-+H+═H2O |
| D、将铜片加入到FeCl3溶液中,Cu+2Fe3+═Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
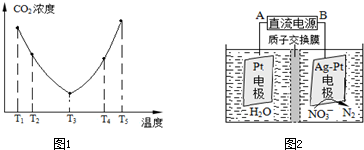
查看答案和解析>>
科目:高中化学 来源: 题型:
 2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
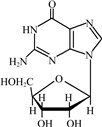
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com