
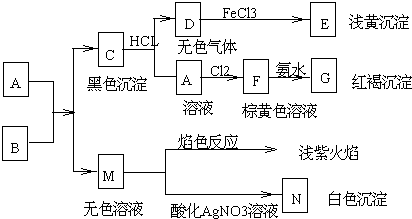
分析 根据转化关系,G为红褐色固体应为Fe(OH)3,所以F为FeCl3,A为FeCl2,D为无色气体,D与氯化铁反应生成E为浅黄色沉淀,则E为S,D为H2S,C为黑色沉淀,则C为FeS,M的焰色反应为浅紫色,则M中含有钾离子,加酸化的硝酸银有白色沉淀N,则N为AgCl,所以M为KCl,A和B反应生成C和M,所以A、B分别是FeCl2,K2S,据此答题;
解答 解:根据转化关系,G为红褐色固体应为Fe(OH)3,所以F为FeCl3,A为FeCl2,D为无色气体,D与氯化铁反应生成E为浅黄色沉淀,则E为S,D为H2S,C为黑色沉淀,则C为FeS,M的焰色反应为浅紫色,则M中含有钾离子,加酸化的硝酸银有白色沉淀N,则N为AgCl,所以M为KCl,A和B反应生成C和M,所以A、B分别是FeCl2,K2S,
(1)根据上面的分析可知,两化合物的化学式A、B分别是FeCl2,K2S,故选B;
(2)C→D是硫化亚铁与盐酸反应生成硫化氢气休,离子方程式为FeS+2H+═Fe2++H2S↑,故答案为:正确;
(3)D→E是硫化氢体与铁离子发生氧化还原反应生成硫和亚铁离子,反应离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,故选A;
(4)A→F为氯化亚铁被氯气氧化成氯化铁,反应的离子方程式为 2Fe2++Cl2═2Fe3++2Cl-,故选C;
(5)F→G为氯化铁中加入氨水,反应的离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,故答案为:正确.
点评 本题考查无机物推断,涉及铁及其化合物的性质、离子方程式书写等,难度不大,物质的颜色为本题的突破口,需要学生熟练掌握元素化合物性质,比较基础,答题时注意铁离子的氧化性的应用.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 可用丁达尔效应区别胶体和溶液 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,P元素属于ds区元素.
,P元素属于ds区元素.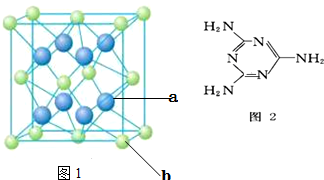
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
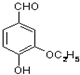 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
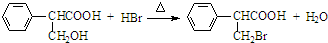 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.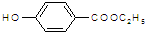 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用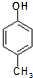 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).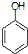 $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$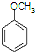 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$
 $→_{催化剂}^{H_{2}△}$
$→_{催化剂}^{H_{2}△}$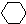 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$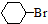
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
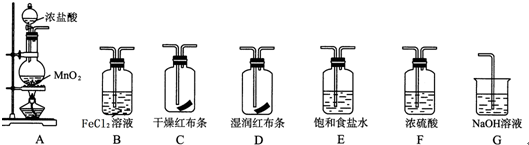
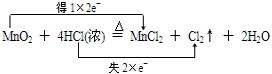 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com