
A、 |
B、 |
C、 |
D、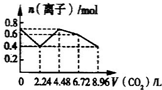 |
| 8.96L |
| 22.4L/mol |
| 8.96L |
| 22.4L/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 物质 编号 |
物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 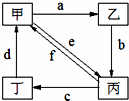 |
Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | CH3CH2Cl | C2H5OH | CH2=CH2 | CH3CH3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 下表中所示概念问的从属关系不符合如图所示的是( )
下表中所示概念问的从属关系不符合如图所示的是( )| 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 卤代烃 | 烃 | 有机物 |
| D | 离子化合物 | 电解质 | 化合物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A、由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |||||||||||
| B、氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |||||||||||
| C、表中②组反应的还原产物是KCl,转移6e- | |||||||||||
D、表中③组反应的离子方程式为2Mn
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①④⑤ |
| C、①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离方程式 | 电离平衡常数K | ||||||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||||||
| H3PO4 | H3PO4?H++H2PO
H2PO
HPO
|
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| A、温度升高,K减小 | ||||||
B、向0.1 mol/L CH3COOH溶液中加入少量冰醋酸,
| ||||||
| C、等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4) | ||||||
D、P
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲区发生的电极反应式为Fe-2e═Fe2+ |
| B、乙区产生Zn2+ |
| C、丙区呈红色 |
| D、丁区呈蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com